
01PCNSL定义
原发中枢神经系统淋巴瘤(primarycentral nervous system lymphoma, PCNSL)是一种罕见的侵袭性淋巴增生性疾病,约占中枢神经系统(CNS)肿瘤的4%、结外淋巴瘤的4-6%。好发于50-60岁人群,男性多见。
PCNSL约95%以上病理类型为弥漫大B细胞淋巴瘤,2018 BSH、2021 ESMO Open指南将PCNSL定义为单独发生于CNS(大脑、脊髓、颅神经、眼睛、脑膜)的弥漫大B细胞淋巴瘤[1-2]。
淋巴瘤CNS转移、免疫缺陷相关淋巴瘤、罕见的非DLBCL中枢淋巴瘤,一般不属PCNSL讨论的范畴。
02接诊PCNSL时需了解的信息[1-2]
PCNSL的临床表现多样,与病灶累及的CNS区域相关,包括大脑、眼、颅神经、软脑膜等。10-20%患者以视觉改变(如飞蚊症、视力模糊、视野缺陷、视力下降等)作为初诊主诉。
颅脑增强MRI是评估PCNSL的最佳方式,病变通常在T2加权MRI上呈等信号/低信号,伴周围水肿及均匀强化。PCNSL在60-70%的病例中为孤立性病灶,多位于大脑半球、基底神经节、胼胝体及脑室周围。
PCNSL可通过脑脊液播散至脑膜,多呈无症状性。
PET-CT在PCNSL的病情评估及疗效评估方面意义尚有限。
初诊PCNSL患者接受激素治疗,约40%患者症状及影像学检查得到快速改善。鉴于肿块缩减可能干扰组织病理学诊断,激素的使用应限于脱水无效的情况,且在诊断性活检前7-10天应停药。
立体定向活检是一种快速、安全的方法,广泛切除可能导致永久性神经功能损害并推迟治疗,对生存无任何裨益。当然,对于需及时控制脑疝或脑室扩张引起的症状的特定患者,应考虑肿瘤切除。
初诊PCNSL的治疗需多学科评估、合作。
03评估
年龄、体能是重要的预后指标。在选择治疗方式时,也需考虑其他因素,包括:并发症、脏器功能、虚弱程度、神经毒性风险。
临床实践中,因并发症、神经功能状态的极大不稳定性,60-75岁的患者常需个体化治疗方案。
2018 BSH指南将PCNSL患者划分为3个亚组[1],有助指导临床:
适合接受强化含大剂量甲氨蝶呤(HD-MTX)的联合治疗;
适合接受含HD-MTX的联合治疗,但不适合高强度联合治疗;
不适合以HD-MTX为基础的治疗,行姑息性医疗(少数患者)。
04治疗策略
PCNSL的现代治疗方案,包含2个阶段:诱导治疗与巩固治疗。
4.1 如何治疗年轻、一般状态良好、适合强化治疗的首诊患者?
2022 CSCO[3]推荐意见
诱导缓解
Ⅰ级推荐:含HD-MTX的全身化疗(1A类);
Ⅱ级推荐:对于存在脊髓病变或脑脊液阳性发现的患者,可在系统治疗基础上联合鞘内注射(2A类);参加临床试验(2A类)。
巩固治疗
Ⅰ级推荐:获得缓解患者:含塞替派预处理方案,自体造血干细胞移植(1类);减低剂量全颅脑放疗(2A类);大剂量阿糖胞苷±依托泊苷,序贯自体造血干细胞移植(2B类)。
维持治疗
Ⅱ级推荐:低剂量来那度胺(3类);替莫唑胺(2B类)。
2022.V1 NCCN[4]推荐意见
诱导治疗
考虑临床试验;或含HD-MTX方案化疗,或其他全身治疗方案(若患者不适宜或不耐受HD-MTX)。若眼部检查提示玻璃体视网膜受累,且疾病经系统治疗无疗效反应,考虑眼部放疗,或咨询有眼内治疗经验的眼科医师;或全脑放疗(WBRT)(若患者不适宜全身系统化疗)。若眼部检查提示玻璃体视网膜受累,考虑眼球放疗。若CSF检查阳性或脊髓MRI检查阳性,考虑鞘内注射化疗+局灶放疗。
2021 ESMO Open[2]推荐意见
推荐方案
基于IELSG32研究[5],4周期MATRix方案(甲氨蝶呤、阿糖胞苷、塞替派、利妥昔单抗)联合化疗后,序贯大剂量化疗+自体干细胞移植(HDC/ASCT),是相对年轻、无严重并发症患者推荐的治疗方案。
取得治疗反应的患者,以ASCT并卡莫司汀、塞替派作为巩固治疗。
外周自体造血干细胞(HSC)通常在第2周期治疗后采集。
关于甲氨蝶呤(MTX)的剂量
MTX剂量通常采用3.5g/m2,3小时输注。剂量调整方面,若需规避严重的毒副反应风险,可降至3g/m2(85%),使不降低中枢神经系统渗透性,保持脑实质与脑脊液中的肿瘤细胞杀伤效应。
关于利妥昔单抗的使用
MATRix方案包含利妥昔单抗,利妥昔单抗在PCNSL中的使用尚存争议。HOVON 105/ALLG NHL 24研究[6]聚焦利妥昔单抗在18-70岁PCNSL患者治疗中的价值,结果证实可为<60岁患者带来生存裨益。但在60岁以上患者,未观察到获益,可能由于这些患者未接受巩固性放疗而致较差的生存,由此掩盖了利妥昔单抗带来的获益。此外,IELSG32研究的长随访数据也证实,使用利妥昔单抗的患者,无进展生存(PFS)、总生存(OS)显著更优!另有研究显示,利妥昔单抗并不影响认知功能。
综上,在MATRix方案中使用利妥昔单抗是合理的。
关于鞘内注射化疗
经现代方案治疗后,软脑膜复发在PCNSL患者并不常见,不推荐鞘内化疗作为一线治疗的一部分。
关于WBRT(全脑放疗)巩固治疗
若诱导治疗期间HSC提取失败或伴严重并发疾病情况下,WBRT可作为ASCT的一个合理替代。
WBRT并非巩固治疗的第一选择,在IELSG32及PRECIS研究中发现,WBRT可增加认知功能损害的风险。
2018 BSH指南[1]——强化型含甲氨蝶呤诱导治疗
方案的选择
含HD-MTX的联合化疗方案可作为新诊断PCNSL的标准治疗方案。
当前治疗一般包含4-8个周期的含HD-MTX方案,并无定数。
IELSG20研究[7]证实,在HD-MTX基础上联合阿糖胞苷,较HD-MTX单药可显著提升完全缓解(CR)率及PFS。
随后IELSG32研究[5]证实,利妥昔单抗+HD-MTX+阿糖胞苷,有助提升治疗反应率。而塞替派+利妥昔单抗联合HD-MTX+阿糖胞苷组成的4药方案(MATRix),则较HD-MTX+阿糖胞苷显著提升OS(2年OS率:69 VS 42%)。
尽管使用利妥昔单抗、HD-MTX已为国际认可,但最佳诱导方案仍未确定。鉴于有更高水平的循证医学证据证实生存获益,推荐使用MATRix方案。
MTX的使用剂量
临床研究中,MTX的应用剂量为3-8g/m2不等,尽管最佳剂量尚未明确,但需重点注意的是,MTX应在2-4小时内,以至少3g/m2的剂量输注,以达到脑脊液(CSF)治疗浓度的最大化,治疗周期间隔10-21天。
MATRix的毒副反应管理
MATRix的治疗相关死亡率约4-7%,多数发生于第1个治疗周期。
鉴于第1周期发生严重感染并导致重症的风险较高,推荐对于毒副风险较大的患者(PS≥2、合并症、>65岁),在起始第1个周期化疗给药时,减低骨髓毒性药物的给药剂量(阿糖胞苷、塞替派),并在随后的周期动态观察、调整剂量。临床实践中,阿糖胞苷25%减量(省略化疗周期中的第4次给药)±塞替派25%减量,是一个合理的治疗策略。
建议使用集落刺激因子及预防性抗感染(针对病毒、细菌感染)治疗。
其他的替代性诱导方案
MT-R(HD-MTX+替莫唑胺+利妥昔单抗),接续多样化的巩固治疗,2年PFS率在57-64%之间。
R-MPV方案(利妥昔单抗+丙卡巴肼+长春新碱+HD-MTX)也展现出不错的疗效。
R-MBVP诱导化疗(利妥昔单抗+HD-MTX+BCNU+泼尼松+依托泊苷)序贯WBRT或HDT-ASCT,该方案在PRECIS研究中,2年OS率达86%。尽管另有研究未能发现该化疗联合利妥昔单抗可带来额外裨益,但分析显示出<60岁患者的PFS获益。
关于鞘内注射化疗
同期鞘内化疗的价值尚不明确。鉴于系统治疗的可靠疗效,及现有有限的临床证据,暂不提倡同期鞘内化疗。
关于外科手术
PCNSL的治疗性外科切除,应限于需紧急手术降颅内压的危急情况。
推荐意见总结
1. 是否适宜化疗,应取决于患者整体的生理状态,而非单纯的年龄。
2. 若条件允许,应考虑参加临床研究。
3. 对于适宜HD-MTX方案治疗的患者:
A:若适宜强化治疗,给予4周期MATRix(HD-MTX、阿糖胞苷、塞替派、利妥昔单抗)治疗。
①对于PS受损、伴并发症和/或MATRix不良反应明显的患者,应考虑减剂量。
②应使用粒细胞刺激因子并防治机会性感染。
③对于计划行HDT-ASCT的患者,PBSC采集应在第2周期治疗后进行。
B:若不适于强化治疗,提供含HD-MTX、利妥昔单抗、一种口服烷化剂的既定方案(如R-MP[利妥昔单抗+MTX+丙卡巴肼])。
C:HD-MTX应以≥3g/m2的剂量使用,2-4h输注,每2-3周给药,至少4周期。
D:利妥昔单抗应以375mg/m2的剂量使用8次。
4. 鞘内化疗不建议与全身治疗同时进行,可考虑用于不适宜全身治疗的、伴软脑膜转移的患者的症状控制。
5 应使用增强MRI进行治疗疗效评估。
A:考虑在第1周期治疗后进行,以指导PBSC的采集。
B:含HD-MTX方案治疗2周期后,常规检查。诱导治疗结束后检查。
4.2 如何治疗年老、虚弱患者?
2022 CSCO[3]推荐意见
诱导缓解
Ⅰ级推荐:全脑放疗(2A类);甲氨蝶呤+替莫唑胺化疗;
维持治疗
Ⅱ级推荐:来那度胺,替莫唑胺(2B类)。
2021 ESMO Open[2]推荐意见
治疗方案的选择
大多数>70岁的老年患者不适合ASCT,经评价后可予含HD-MTX(大剂量甲氨蝶呤)的化疗。肾功能正常、充足的骨髓造血功能储备、心功能正常(EF值≥45%,近期无急性冠脉疾病或未控制的心律失常)的患者,可考虑该治疗方案。
推荐HD-MTX+烷化剂(替莫唑胺等)+利妥昔单抗联合方案。
对不适用HD-MTX的患者,初始给予WBRT是一个合理的选择,2年PFS率约30%。
巩固治疗策略
取得病情控制的患者,可考虑低剂量WBRT(23.4Gy)巩固治疗,或口服烷化剂维持治疗。
回顾性研究显示,>70岁的老年患者,若体能状态佳、脏器功能正常,也可考虑HDC/ASCT。这部分患者,可考虑MATRix减量25%方案作为诱导治疗。
2018 BSH指南[1]——低强度含甲氨蝶呤诱导治疗
概述
如果生理条件允许(尤其心、肾功能充足),则年龄不应成为HD-MTX(>3g/m2)安全给药的障碍(LVEF>45%、肌酐清除率>50ml/min)。
PRIMAIN研究[8]使用利妥昔单抗+丙卡巴肼+洛莫司汀诱导化疗,随后以丙卡巴肼维持,治疗≥65岁的PCNSL患者。因洛莫司汀的毒性较大,在剔除洛莫司汀后未造成疗效的损失。使用或不使用洛莫司汀,2年OS率分别为47.9%、46%。
欧洲一项研究[9]中,使用降低剂量的HD-MTX+替莫唑胺诱导治疗,随后以替莫唑胺维持1年,治疗65-75岁患者,2年OS率55.6%。这与年轻队列接受相同方案、更高强度治疗后的数据相近(2年OS率:60.7%)。
纳入>60岁患者的Ⅱ期研究[10]中,HD-MTX+丙卡巴肼+长春新碱+阿糖胞苷,较HD-MTX+替莫唑胺,无额外的生存获益,2组患者的1年PFS率均为36%。
Kasenda et al开展[11]的Meta分析纳入20项研究的数据显示,>60岁的患者,使用含HD-MTX的治疗方案有助改善OS。
推荐意见总结
1. 是否适宜化疗,应取决于患者整体的生理状态,而非单纯的年龄。
2. 若条件允许,应考虑参加临床研究。
3. 对于适宜HD-MTX方案治疗的患者:
A:若适宜强化治疗,给予4周期MATRix(HD-MTX、阿糖胞苷、塞替派、利妥昔单抗)治疗。
①对于PS受损、伴并发症和/或MATRix不良反应明显的患者,应考虑减剂量。
②应使用粒细胞刺激因子并防治机会性感染。
③对于计划行HDT-ASCT的患者,PBSC采集应在第2周期治疗后进行。
B:若不适于强化治疗,提供含HD-MTX、利妥昔单抗、一种口服烷化剂的既定方案(如R-MP[利妥昔单抗+MTX+丙卡巴肼])。
C:HD-MTX应以≥3g/m2的剂量使用,2-4h输注,每2-3周给药,至少4周期。
D:利妥昔单抗应以375mg/m2的剂量使用8次。
4.3 诱导缓解后的巩固治疗
2022.V1 NCCN[4]推荐意见
诱导治疗后CR或CRu(未证实的CR)
大剂量化疗+干细胞移植;或大剂量阿糖胞苷±依托泊苷;或低剂量WBRT;或继续含HD-MTX方案每月化疗至满1年。
仍有残留病灶
WBRT;或考虑大剂量阿糖胞苷±依托泊苷;或最佳支持治疗。
2021 ESMO Open[2]推荐意见
年轻、适合强化治疗的患者
首选ASCT:4周期MATRix方案化疗后,序贯大剂量化疗+自体干细胞移植(HDC/ASCT),是相对年轻、无严重并发症患者推荐的治疗方案。取得治疗反应的患者,以ASCT并卡莫司汀、塞替派作为巩固治疗。备选WBRT:若诱导治疗期间HSC提取失败或伴严重并发疾病情况下,WBRT可作为ASCT的一个合理替代。WBRT并非巩固治疗的第1选择,在IELSG32及PRECIS研究[12]中发现,WBRT可增加认知功能损害的风险。
年老、虚弱患者
诱导治疗取得病情控制的患者,可考虑低剂量WBRT(23.4Gy)巩固治疗,或口服烷化剂维持治疗。
回顾性研究[13]显示,>70岁的老年患者,若体能状态佳、脏器功能正常,也可考虑HDC/ASCT。这部分患者,可考虑MATRix减量25%方案作为诱导治疗。
2018 BSH指南[1]推荐意见
4周期MATRix诱导治疗后取得SD或PR或CR的患者,接受巩固治疗(WBRT或ASCT)。
2周期MATRix后,外周血干细胞(PBSC)在96%的患者采集成功。2周期以后推迟采集,成功率可能下降。
推荐意见:
1. 所有诱导化疗后疾病取得控制、未进展的患者,均应考虑巩固治疗。需根据患者的合并症、PS状态、神经认知功能及患者意愿。
2. 所有患者应考虑,以含大剂量塞替派化疗方案+ASCT作为一线巩固方案。
A:含HD-MTX方案一线诱导化疗后至少取得SD的PCNSL患者,需考虑HDT-ASCT。
B:BEAM(卡莫司汀+依托泊苷+阿糖胞苷+美法仑)不应作为PCNSL的巩固方案。
3. 部分患者可考虑WBRT巩固放疗±局部加量:
A:诱导化疗后有残留病灶,不适宜HDT-ASCT的患者。
B:含塞替派ASCT治疗后伴残留病灶的患者。
4. 同时合并眼部受累的患者若不适合HDT-ASCT,或在含塞替派ASCT治疗后未达CR,可考虑双侧眼部放疗。
5. HD-MTX方案治疗后CR、不适合HDT-ASCT的患者,WBRT是有一定争议的:
A:可能改善PFS但需仔细权衡患者的神经认知毒性。
B:≥60岁的患者、HD-MTX方案治疗后CR,鉴于神经认知毒性较高,应略过WBRT,或考虑施行低剂量WBRT。
6. 当采取WBRT治疗时,推荐根据年龄、并发症、接受的诱导治疗等情况,采用下述的剂量建议:
A:36Gy,20次照射。
B:预计神经毒性高的患者,减剂量方案(23.4Gy/1.8-2Gy分割剂量)。
C:考虑在WBRT时,对残留病灶给予9Gy加量,外扩1-2cm。总剂量45Gy/25f。
D:眼部应在30Gy(眼部受累则为36Gy)照射后予以保护。
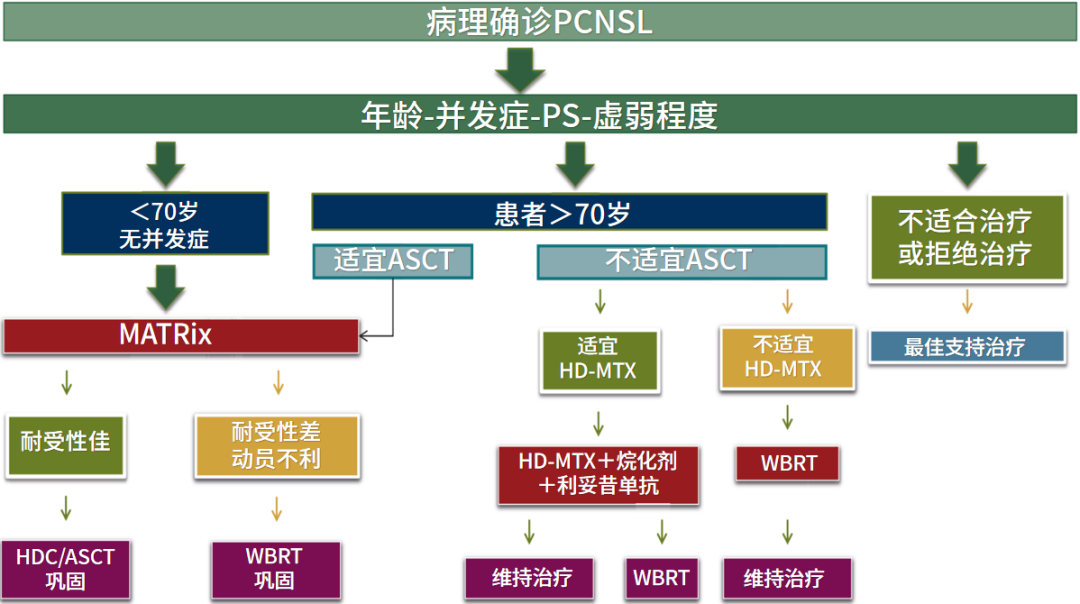
图1:2021 ESMO Open PCNSL治疗策略[2]
4.4 复发/难治PCNSL(R/R PCNSL)的治疗
2022 CSCO[3]推荐意见
既往接受全脑放疗的患者
Ⅰ级推荐:临床试验;全身化疗±自体造血干细胞移植(2B类);姑息治疗(2A类);
Ⅱ级推荐:BTK抑制剂±化疗(2B类)。
既往接受大剂量MTX全身化疗,无放疗史
缓解时间≥12个月
Ⅰ级推荐:临床试验;其他化疗方案±自体造血干细胞移植(2B类);姑息治疗(2A类);
Ⅱ级推荐:BTK抑制剂±化疗(2B类);重复大剂量MTX方案化疗(2B类);全脑放疗(2A类);
缓解时间<12个月
Ⅰ级推荐:临床试验;全脑或局部放疗±其他方案化疗(2B类);其他方案化疗±自体造血干细胞移植(2B类);姑息治疗(2A类);
Ⅱ级推荐:BTK抑制剂±化疗(2B类)。
2022.V1 NCCN[4]推荐意见
任意治疗史
考虑临床试验;
既往经WBRT
考虑全身系统化疗(系统和/或鞘内);或考虑大剂量化疗+干细胞移植;或考虑局部放疗;或姑息/最佳支持治疗;
既往经HD-MTX化疗、无放疗史
既往获得缓解≥12个月
再使用HD-MTX+其他系统治疗方案;或其他系统治疗方案;或考虑大剂量化疗+干细胞移植;或姑息/最佳支持治疗;
无治疗反应或缓解时间<12个月
其他系统治疗方案;或WBRT或受累野放疗±其他系统治疗;或考虑大剂量化疗+干细胞移植;或姑息/最佳支持治疗;
既往经大剂量化疗后干细胞移植
既往获得缓解≥12个月
考虑其他大剂量化疗+干细胞移植;或其他系统治疗;或最佳支持治疗;
无治疗反应或缓解时间<12个月
WBRT或受累野放疗;或其他系统治疗;或姑息/最佳支持治疗。
2021 ESMO Open[2]推荐意见
治疗策略
尚无复发/难治PCNSL患者的标准治疗意见。推荐参加临床试验,因可能潜在获益。
较迟复发(复发时间距末次治疗>24个月)、既往经含HD-MTX方案治疗有效的患者,再挑战HD-MTX不失为安全、有效的策略。
而对于较早复发的患者,推荐含大剂量异环磷酰胺的方案,如R-IE(利妥昔单抗+异环磷酰胺+依托泊苷),其客观缓解率(ORR)为38%,复发后的2年OS率25%。
巩固治疗:较迟或较早复发的患者,推荐治疗后,接受巩固或维持治疗。具体方案的选择需参考既往的治疗、自体造血干细胞可及性、并发症及患者的一般状况。
新兴药物
mTOR抑制剂temsirolimus在经多线治疗、老年患者中取得54%的ORR,但毒副反应及13.5%的治疗相关性死亡率限制了其使用。
新药BTK抑制剂伊布替尼(ibrutinib)单药或联合化疗,治疗CNS淋巴瘤取得迅速而显著的疗效。以560mg/天给药时,ORR为50%,剂量爬升至840mg时ORR可达77%。需注意的是,有报道称侵袭性曲霉菌病的患病风险增加(39%的患者)。及时停药或免除激素用药,或可预防这一严重并发症。
复发、难治性PCNSL,或原发性玻璃体视网膜淋巴瘤患者,使用免疫调节剂(来那度胺、泊马度胺)可取得约50%的ORR,但治疗反应时间通常是短暂的。
鉴于PD-1单抗的疗效并不明朗,暂不推荐。
CAR-T疗法获批用于复发、难治性弥漫大B细胞淋巴瘤,参考其出色的疗效,值得在PCNSL进一步探索其治疗潜力。
2018 BSH指南[1]推荐意见
复发/难治PCNSL(R/R PCNSL)的治疗仍是临床未解决的难题。Langner-Lemercier的研究[14]中,R/R PCNSL的中位OS仅为3.5个月。
治疗方案的选择
含异环磷酰胺方案
含异环磷酰胺的化疗方案,通常联合依托泊苷±卡铂、利妥昔单抗(R-IE/R-ICE),治疗化疗耐药,或既往经多线治疗的患者,可取得41-95%的ORR。
含HD-MTX方案再挑战
对于既往经HD-MTX方案治疗取得显著缓解的患者,再使用含HD-MTX方案可能是有效的。两项回顾性研究[15-16]中,患者再使用含HD-MTX分别取得16、25.8个月的mPFS,而两个研究中患者一线含HD-MTX的治疗反应时间分别持续24.4、26个月。可能更适于既往有MTX治疗经历,但未经利妥昔单抗、塞替派治疗的、MATRix方案潜在获益的患者。
新兴药物
新兴药物不断涌现,单药Ibrutinib、nivolumab的ORR>50%。来那度胺可穿透血脑屏障,联合利妥昔单抗治疗PCNSL观察到抗癌疗效。
巩固治疗
对于化疗敏感的患者,现有数据支持在R/R PCNSL的治疗中应用基于塞替派的HDT-ASCT,mPFS可达24-41个月。
若一线治疗后未予HDT-ASCT或WBRT,应在二次缓解时考虑。
HD-MTX治疗失败、既往未经放疗的患者,单纯WBRT(36-40Gy)的CR率有37-58%,中位生存为10-16个月。
推荐总结
1. 所有怀疑PCNSL复发的患者,均应采取MDT模式。
2. 对于颅内新发不典型的MRI异常病灶,或首次治疗2年后出现的新发病灶,建议重新取活检,尤其对计划进行积极的、强化挽救性治疗的患者。
3. 确诊复发PCNSL的患者,在积极治疗前,应再次评估分期。对于一线治疗无效的PCNSL,无需重新评估分期。
4. 若条件允许,应考虑参加临床研究。
5. 临床试验之外,潜在可考虑的治疗方案应个体化,考虑患者的实际情况,包括:
A:生理状态、PS、神经认知功能。
B:既往治疗及疗效持续时间。
C:患者主管的意愿与选择。
6. 适合强化治疗的患者:
A:考虑基于异环磷酰胺的化疗方案,尤其针对难治性患者及MTX方案治疗后早期复发的患者。
B:若距离含HD-MTX方案取得首次治疗缓解的时间已>2年,考虑含HD-MTX的治疗方案。
7. 挽救性化疗后的巩固治疗:
A:再次取得治疗缓解后,未行HDT-ASCT的患者,可考虑含塞替派HDT-ASCT。
B:既往未行WBRT而现在不适合HDT-ASCT的患者,或已行HDT-ASCT的患者,考虑WBRT(23.4-36Gy/1.8-2Gy分割剂量),单纯放疗,或在挽救性化疗后接续放疗。
8. 不适宜给予强化治疗的患者:
A:给予姑息性治疗,包括WBRT(23.4-36Gy/1.8-2Gy分割剂量)、激素和/或口服替莫唑胺。
B:最佳支持治疗。
4.5 姑息性医疗
2021 ESMO Open[2]推荐意见
可参考“4.2 如何治疗年老、虚弱患者?”部分。
2018 BSH指南[1]推荐意见
概述
对于无法耐受以MTX为基础的治疗方案的患者,仍有可靠的治疗方案可供选择。
WBRT、激素、口服化疗药物是普遍的治疗选择。
Kurzwelly et al的小型回顾性研究[17]显示(n=19),老年PCNSL患者口服单药替莫唑胺的CR率高达47%,mPFS为5个月,mOS达21个月。
≥60岁的患者,单纯WBRT(40Gy+20Gy加量)产生的中位生存仅7.6个月。更低剂量、更短疗程的方案(20-30Gy/1.8-4Gy分割剂量)可能更实用。
推荐意见
对于不适宜HD-MTX治疗的患者,考虑下述单项或多项组合治疗:
A:口服化疗药物(如替莫唑胺)。
B:WBRT(20-30Gy/1.8-4Gy分割剂量,据PS、治疗目的、预期寿命等调整)±眼部放疗(若合并眼部受累)。
C:激素(通常使用地塞米松)。
05新兴药物与治疗
5.1 BTK抑制剂(BTKi)
PCNSL携带可上调BCR信号通路的基因突变,BTK抑制剂可靶向结合BCR信号通路,尤其对携带BCR亚型CD79B和MYD88突变的淋巴瘤具备高活性[18]。
PCNSL高度依赖BCR信号,BTK抑制剂伊布替尼(ibrutinib)治疗PCNSL具备可行性。
表1:伊布替尼治疗R/R PCNSL的数据概览
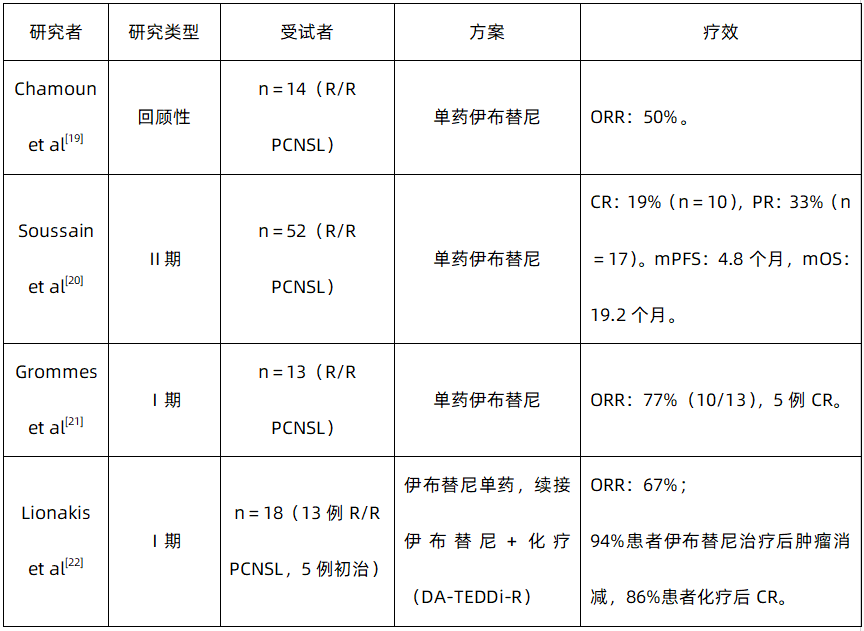
伊布替尼的耐受性良好。
5.2 免疫治疗
复发/难治PCNSL目前并无标准治疗方案,预后极差。R/R PCNSL倾向于高表达PD-1配体:PD-L1及PD-L2[23],此类患者能否从免疫治疗中获益?
Nayak L, et al的研究[23]中,4例R/R PCNSL接受nivolumab免疫治疗,均取得临床及影像学缓解。
5.3 CAR-T
CAR-T疗法在血液肿瘤中取得巨大成功,但治疗PCNSL的潜力并不清楚。CAR-T相关脑病综合征限制了该疗法在PCNSL的探索[24]。
有限的治疗探索中,CAR-T治疗R/R PCNSL取得不俗疗效。
表2:CAR-T疗法治疗R/R PCNSL数据概览
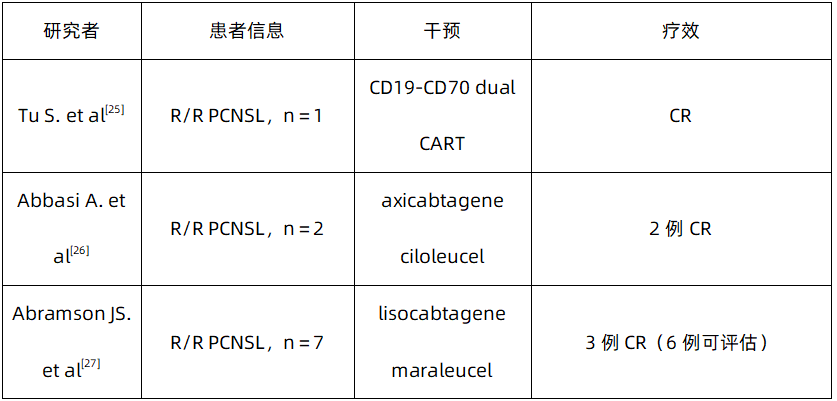
5.4 免疫调节剂(IMiD)
IMiD可增强NK细胞的细胞毒性,促进T细胞增殖、增加IL-2及IFN-γ的生成,调节IL-12的表达。联合使用IMiD+利妥昔单抗治疗非霍奇金淋巴瘤具有协同效应[24]。
来那度胺单药治疗复发/难治性中枢淋巴瘤,ORR为64%[28]。来那度胺+利妥昔单抗诱导治疗,ORR为64.7%(22/35),12例CR[29]。
参考文献
[1] Fox CP, Phillips EH, Smith J, et al. Guidelines for the diagnosis and management of primary central nervous system diffuse large B-cell lymphoma[J]. Br J Haematol. 2019 Feb;184(3):348-363. doi: 10.1111/bjh.15661.
[2] Calimeri T, Steffanoni S, Gagliardi F, et al. How we treat primary central nervous system lymphoma. ESMO Open. 2021 Aug;6(4):100213. doi: 10.1016/j.esmoop.2021.100213.
[3] 中国临床肿瘤学会指南工作委员会.淋巴瘤诊疗指南2022[M].人民卫生出版社,2022:89-103.
[4] Louis BN, Jana P, Joachin B, et al. Central Nervous System Cancers, Version 1.2022, NCCN Clinical Practice Guidelines in Oncology. 2022.
[5] Ferreri AJM, Cwynarski K, Pulczynski E, et al. Whole-brain radiotherapy or autologous stem-cell transplantation as consolidation strategies after high-dose methotrexate-based chemoimmunotherapy in patients with primary CNS lymphoma: results of the second randomisation of the International Extranodal Lymphoma Study Group-32 phase 2 trial[J]. Lancet Haematol. 2017;4(11):e510-e523.
[6] Bromberg JEC, Issa S, Bakunina K, et al. Rituximab in patients with primary CNS lymphoma (HOVON 105/ALLG NHL 24): a randomised, open-label, phase 3 intergroup study[J]. Lancet Oncol. 2019;20(2):216-228.
[7] Ferreri AJ, Reni M, Foppoli M, et al. High-dose cytarabine plus high-dose methotrexate versus high-dose methotrexate alone in patients with primary CNS lymphoma: a randomised phase 2 trial[J]. Lancet, 2009, 374, 1512–1520.
[8] Fritsch K, Kasenda B, Schorb E, et al. Highdose methotrexate-based immuno-chemotherapy for elderly primary CNS lymphoma patients(PRIMAIN study) [J].Leukemia, 2017, 31, 846–852.
[9] Pels H, Schmidt-Wolf IG, Glasmacher A, et al. Primary central nervous system lymphoma: results of a pilot and phase II study of systemic and intraventricular chemotherapy with deferred radiotherapy[J]. Journal of Clinical Oncology, 2003, 21, 4489–4495.
[10] Omuro A, Chinot O, Taillandier L, et al. Methotrexate and temozolomide versus methotrexate, procarbazine, vincristine, and cytarabine for primary CNS lymphoma in an elderly population: an intergroup ANOCEFGOELAMS randomised phase 2 trial[J]. Lancet Haematology, 2015, 2, e251–e259.
[11] Kasenda B, Ferreri AJ, Marturano E, et al. First-line treatment and outcome of elderly patients with primary central nervous system lymphoma (PCNSL) – a systematic review and individual patient data meta-analysis[J]. Annals of Oncology, 2015, 26, 1305–1313.
[12] Houillier C, Taillandier L, Dureau S, et al. Radiotherapy or autologous stem-cell transplantation for primary CNS lymphoma in patients 60 years of age and younger: results of the intergroup ANOCEF-GOELAMS randomized phase II PRECIS study[J]. J Clin Oncol. 2019;37(10):823-833.
[13] Schorb E, Fox CP, Fritsch K, et al. High-dose thiotepa-based chemotherapy with autologous stem cell support in elderly patients with primary central nervous system lymphoma: a European retrospective study[J]. Bone Marrow Transplant. 2017;52(8):1113-1119.
[14] Langner-Lemercier S, Houillier C, Soussain C, et al. Primary CNS lymphoma at first relapse/progression: characteristics, management, and outcome of 256 patients from the French LOC network[J]. Neuro Oncology, 2016, 18, 1297–1303.
[15] Plotkin SR, Betensky RA, Hochberg FH, et al. Treatment of relapsed central nervous system lymphoma with high-dose methotrexate[J]. Clinical Cancer Research, 2004, 10, 5643–5646.
[16] Pentsova E, Deangelis LM, Omuro A. Methotrexate re-challenge for recurrent primary central nervous system lymphoma[J]. Journal of Neurooncology, 2014, 117, 161–165.
[17] Kurzwelly D, Glas M, Roth P, et al. Primary CNS lymphoma in the elderly: temozolomide therapy and MGMT status[J]. Journal of Neurooncology, 2010, 97, 389–392.
[18] T Low J, B Peters K. Ibrutinib in primary central nervous system diffuse large B-cell lymphoma[J]. CNS Oncol. 2020 Mar 1;9(1):CNS51. doi: 10.2217/cns-2019-0022.
[19] Chamoun K, Choquet S, Boyle E et al. Ibrutinib monotherapy in relapsed/refractory CNS lymphoma: a retrospective case series[J]. Neurology 88(1), 101–102 (2017).
[20] Soussain C, Choquet S, Blonski M, et al. Ibrutinib monotherapy for relapse or refractory primary CNS lymphoma and primary vitreoretinal lymphoma: final analysis of the Phase II ‘proof-of-concept’ iLOC study by the Lymphoma study association (LYSA) and the French oculo-cerebral lymphoma (LOC) network[J]. Eur. J. Cancer 117, 121–130 (2019).
[21] Grommes C, Pastore A, Palaskas N, et al. Ibrutinib unmasks critical role of bruton tyrosine kinase in primary CNS lymphoma[J]. Cancer Discov. 7(9), 1018–1029 (2017).
[22] Lionakis MS, Dunleavy K, Roschewski M, et al. Inhibition of B cell receptor signaling by ibrutinib in primary CNS lymphoma[J]. Cancer Cell 31(6), 833.e5–843.e5 (2017).
[23] Nayak L, Iwamoto FM, LaCasce A, et al. PD-1 blockade with nivolumab in relapsed/refractory primary central nervous system and testicular lymphoma[J]. Blood. 2017 Jun 8;129(23):3071-3073. doi: 10.1182/blood-2017-01-764209.
[24] Yuan Y, Ding T, Wang S, et al. Current and emerging therapies for primary central nervous system lymphoma[J]. Biomark Res. 2021 May 6;9(1):32. doi: 10.1186/s40364-021-00282-z.
[25] Tu S, Zhou X, Guo Z, et al. CD19 and CD70 Dual Target Chimeric Antigen Receptor T-Cell Therapy for the Treatment of Relapsed and Refractory Primary Central Nervous System Diffuse Large B Cell Lymphoma[J]. Front Oncol. 2019;9:1350.
[26] Abbasi A, Peeke S, Shah N, et al. Axicabtagene ciloleucel CD19 CAR-T cell therapy results in high rates of systemic and neurologic remissions in ten patients with refractory large B cell lymphoma including two with HIV and viralhepatitis[J]. J Hematol Oncol. 2020;13(1):1.
[27] Abramson JS, Palomba ML, Gordon LI, et al. Lisocabtagene maraleucel for patients with relapsed or refractory large B-cell lymphomas (TRANSCEND NHL 001): a multicentre seamless design study[J]. Lancet. 2020;396(10254):839–52.
[28] Rubenstein JL, Geng H, Fraser EJ, et al. Phase 1 investigation of lenalidomide/rituximab plus outcomes of lenalidomide maintenance in relapsed CNS lymphoma[J]. Blood Adv. 2018;2(13):1595–607.
[29] Ghesquieres H, Chevrier M, Laadhari M, et al. Lenalidomide in combination with intravenous rituximab (REVRI) in relapsed/refractory primary CNS lymphoma or primary intraocular lymphoma: a multicenter prospective 'proof of concept' phase II study of the French Oculo-Cerebral lymphoma (LOC) Network and the Lymphoma Study Association (LYSA)dagger[J]. Ann Oncol. 2019;30(4):621–8.