近年来,国际上对霍奇金病的诊断和研究有3大发展:R-S细胞与EB病毒密切关系的的确定,对R-S细胞来源的初步认识(来源于B细胞)和新的改进分类的提出(REAL分类和WHO分类草案)〔1~6〕。本文根据新的分类,结合作者单位近年来诊断数百例霍奇金病的经验,从临床病理角度出发,对霍奇金病的诊断和鉴别诊断加以介绍。
1 霍奇金
淋巴瘤分类的回顾和发展
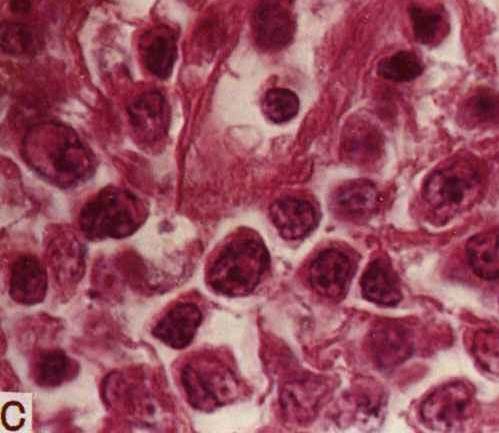
40年代后期Jackson和Paker分类将霍奇金病分为肉芽肿、副肉芽肿和肉瘤3种亚型。1966年Lukes等提出的分类有6个亚型。同年的Rye分类将Lukes分类做了一些简化和命名的改动,得到广泛应用。之后Lennert提出的Kiel分类在欧洲得到应用。1994年的REAL分类〔3,4〕增加了“富于淋巴细胞的经典霍奇金病”亚型,相当于Lukes和Butler分类的淋巴细胞和组织细胞为主型中弥漫型的一部分及Kiel分类的淋巴细胞为主的混合细胞型。在此基础上,1997年WHO委托Stein等制定了新分类草案〔5〕,各种分类比较见表1。WHO方案依据新的分子生物学研究证实霍奇金病的肿瘤细胞——R-S细胞实际上来源于淋巴细胞的事实,将霍奇金病更名为霍奇金
淋巴瘤。将其分为淋巴细胞为主型〔大致相当于传统的结节型副肉芽肿,即结节型淋巴细胞和(或)组织细胞为主型〕和经典的霍奇金淋巴瘤两大类。经典的霍奇金淋巴瘤又可分为4类:①结节硬化型,②富于淋巴细胞的经典霍奇金淋巴瘤〔大致相当于传统的弥漫型淋巴细胞和(或)组织细胞为主型〕,③混合细胞型,④具有霍奇金淋巴瘤和大细胞间变型淋巴瘤特点的恶性淋巴瘤。而淋巴细胞减少型则被具有霍奇金淋巴瘤和大细胞间变淋巴瘤特点的恶性淋巴瘤所取代(表2)。为了便于同行理解,仍然按照原有的4型分类介绍,并指出和新分类的关系。
2 经典的霍奇金淋巴瘤〔1,2〕
2.1 结节硬化型(nodular sclerosis, HDNS)
2.1.1 组织学和免疫组化改变 HDNS命名来源于在此型晚期肿大的淋巴结为宽大的胶原束分割成境界清楚的结节。这种胶原束在偏光显微镜下呈双折光性,经常围绕在血管周围。结节内除了典型的R-S细胞外,还有腔隙型或胞浆型的R-S细胞(陷窝细胞)。腔隙型细胞大(40~50 μm直径),胞浆丰富而空亮,核多叶而皱折,核仁较典型的R-S细胞小。胞浆的空亮是由于福尔马林固定后胞浆收缩至核膜附近所产生的。在Zenker液或B5液固定的组织中不出现腔隙。某些病例可出现有成片的腔隙型R-S细胞,尤其在硬化区周围。成片的腔隙型细胞容易被误为大细胞性非霍奇金淋巴瘤、癌、生殖细胞肿瘤或胸腺瘤。具有这种特点的HDNS称为合体细胞变体、肉瘤样变体或肉瘤性变体。HDNS肿瘤细胞(包括R-S细胞和陷窝细胞)的免疫表型为CD15+、CD30+、LCA-。
表1 各种霍奇金病形态学分类的比较
表2 WHO关于霍奇金淋巴瘤分类的提议(1997)
结节型淋巴细胞为主型霍奇金淋巴瘤
+/-弥漫性区域
经典的霍奇金淋巴瘤
经节硬化型(Ⅰ级和Ⅱ级)
经典霍奇金淋巴瘤,富于淋巴细胞
混合细胞型
恶性淋巴瘤伴有霍奇金淋巴瘤和大细胞
间变性淋巴瘤的特点(以前称为霍奇金样大细胞间变性淋巴瘤)
受累淋巴结的典型改变为被膜明显增厚纤维化,从此延伸出纤维束将淋巴结分割为大小不一的结节。结节内腔隙型R-S细胞分散在由数量不一的淋巴细胞、嗜酸性粒细胞、组织细胞、中性粒细胞和浆细胞组成的背景中。诊断性R-S细胞一般少见。
有些作者认为腔隙型R-S细胞是较纤维化更重要的特征。在无纤维化时,只要有腔隙型R-S细胞的存在就可诊断HDNS(所谓“细胞期”)。但腔隙型R-S细胞并不是结节硬化型特有的,也可见于HDMC,甚至反应性病变。德国科隆大学的Fischer教授提出HDNS诊断的2/3原则:即3种主要的组织学改变—诊断性R-S细胞、腔隙型R-S细胞和硬化,可以按照不同的比例组成各种各样的“面孔”。只要有其中两种改变就可诊断结节硬化型霍奇金病。
HDNS病变中的非肿瘤性成分变化极大。由此有作者提出将此型再分为淋巴细胞为主型、混合细胞型和淋巴细胞减少型。这种再分型与预后相关。英国淋巴瘤研究组也提出将HDNS为分为Ⅰ级和Ⅱ级两组。将出现以下特点之一的病例列入更具侵袭性的Ⅱ级:(1)在超过25%的细胞性结节中出现淋巴细胞减少,不考虑是否有肿瘤性细胞的一致性或间变;(2)超过80%的细胞性结节中出现“纤维组织细胞性”模式,即相对减少的腔隙型细胞或典型R-S细胞伴有多量的组织细胞和纤维母细胞;(3)在不伴有淋巴细胞减少的情况下,25%以上的结节中出现众多的、高度怪异的间变性R-S细胞和霍奇金细胞。可疑的或边界性的病例划为Ⅰ级。前述的“合体细胞型”NS属于Ⅱ级。
2.1.2 鉴别诊断 (1)坏死性淋巴结炎和猫抓病。有的HDNS病例,尤其是纵膈和下颈部的淋巴结活检,可以出现广泛的凝固性坏死或者化脓性坏死,从而掩盖肿瘤性特点。可能被误诊为坏死性淋巴结炎或猫抓病性淋巴结炎。此时寻找腔隙型R-S细胞和经典的R-S细胞的最佳部位是在坏死灶的边缘。有时腔隙型R-S细胞具有较小的核仁,与组织细胞不易鉴别。CD30(BerH2)的免疫组化染色可以帮助区别。CD15(LeuM1)染色在此时无用,因为组织细胞也呈CD15阳性。(2)硬化性炎症和硬化性纵膈炎。HDNS常常伴有明显的纤维化和硬化,在小活检中容易误为硬化性炎症。因此,如果在纵膈和下颈部的活检中有硬化,即使没有找到腔隙型细胞,只要临床表现支持淋巴瘤诊断,也应怀疑HDNS,可以做连续切片或者再次活检。(3)恶性纤维组织细胞瘤。HDNS的纤维组织细胞-纤维母细胞性变种可以被误诊为恶性纤维组织细胞瘤。如注意到梭形细胞不具有明显的异形性,仔细寻找可偶然见到腔隙型细胞和典型的R-S细胞,可以肯定HDNS的诊断。(4)转移癌。合体细胞型的HDNS与转移癌和恶性黑色素瘤区别困难。边缘窦侵犯,梭形肿瘤细胞,核的多型性,以及中性粒细胞穿入肿瘤细胞的现象有力地支持转移癌的诊断。如果难以区别,可以借助免疫组化染色。(5)大细胞淋巴瘤。合体细胞型的HDNS和大细胞淋巴瘤的明确区别非常困难。出现典型的结节硬化型改变的区域有助于霍奇金病的诊断,虽然霍奇金病和非霍奇金淋巴瘤的组合性淋巴瘤可以发生,但毕竟太少见。免疫组化染色:HDNS的肿瘤细胞一般为LCA-、CD15+,而大细胞淋巴瘤通常为LCA+、CD15-,并且有T或者B细胞标记。(6)淋巴结病毒感染与HDNS细胞期的鉴别。在传染性单细胞增多症等病毒性疾病,副皮质区可见免疫母细胞的增生,其核仁大,居中,类似R-S细胞,且CD30阳性,有时胞浆空亮,类似陷窝细胞。此时还有其他病毒感染的特点,如滤泡增生,副皮质区扩大,血管增多以及灶性坏死等。嗜酸性粒细胞少见,且无典型霍奇金淋巴瘤的背景和硬化。
2.2 混合细胞型(mixture cellularity, HDMC)
2.2.1 组织学和免疫组化改变 HDMC的淋巴结部分或者弥漫性受累,嗜酸性粒细胞、浆细胞和单个核的霍奇金细胞与数量相当多典型的R-S细胞相混合。还可见到数量相当多的免疫母细胞,以及介于霍奇金细胞和免疫母细胞之间的非典型细胞。在经典的教科书上将背景淋巴细胞描述为未活化的小淋巴细胞。实际上,背景淋巴细胞较小淋巴细胞为深,核不规则,甚至有反应性的母细胞出现(T细胞),还有灶性坏死,坏死灶周围可有纤维化,但胶原纤维无双折光;有时可见较多的上皮样细胞团,甚至可有肉芽肿形成。免疫组化染色R-S细胞和霍奇金细胞为CD15+,CD30+,LCA-。
2.2.2 鉴别诊断 (1)周围T细胞淋巴瘤。HDMC与周围T细胞淋巴瘤有时难以区别。周围T细胞淋巴瘤的瘤细胞具有更大的异形性,形成从小细胞到大细胞的谱系,甚至:大细胞具有嗜酸性的核仁,以及嗜酸粒细胞,上皮样细胞和血管增生的背景。核的不规则和分叶,染色质呈细颗粒状,空亮的胞浆支持周围T细胞淋巴瘤的诊断。免疫组化染色时,CD30和CD15的阳性反应出现于大细胞,从而支持霍奇金病的诊断。由于HDMC和周围T细胞淋巴瘤都是富于T细胞的肿瘤,对T细胞标记染色的解释应相当谨慎。(2)富于T细胞的B细胞淋巴瘤。富于T细胞性的B细胞淋巴瘤极易误为霍奇金病,但是大B细胞通常不具有R-S细胞的大而红染的核仁,核形不规则的变异程度也更大。免疫组化染色大细胞呈LCA和B细胞标记阳性反应,而且有单克隆性的免疫球蛋白表达。在此,对于L26(CD20)染色的解释应当谨慎对待,因为R-S细胞也可以阳性(表3)。(3)反应性免疫母细胞增生,例如传染性单核细胞增多症,有时也可以见到R-S样细胞。但是背景中有大量增生的活化淋巴细胞和免疫母细胞,而没有众多的嗜酸性粒细胞和浆细胞,可以和霍奇金病区别。(4)滤泡间“霍奇金样”淋巴结炎。淋巴结反应性增生的滤泡间区为主型可见滤泡间的淋巴细胞、免疫母细胞、浆细胞、嗜酸性粒细胞和上皮样组织细胞和血管增生,形成类似霍奇金病的图象。但免疫母细胞较R-S细胞小,核仁嗜碱性而不嗜酸性。免疫反应具有T或者B细胞标记,而CD15阴性。(5)转移癌或黑色素瘤。转移癌(特别是鼻咽癌)或黑色素瘤以分散形式侵犯淋巴结,尤其是癌细胞具有明显的嗜酸性核仁时,可能与霍奇金病引起误会。成团聚集的肿瘤细胞支持转移癌的诊断,必要时可做免疫组化加以区别。(6)伴有多量上皮样细胞的淋巴浆细胞性淋巴瘤(免疫细胞瘤)。
表3 富于T细胞的大B细胞淋巴瘤和
经典霍奇金病的免疫表型区别*
免疫表型 富于T细胞大B细胞
淋巴瘤中的大细胞
经典霍奇金病
中的R-S细胞
LCA(CD45RB) 一般阳性 一般阴性
B细胞标记 阳性 某些病例少量R-S 细胞CD20+
胞浆免疫球蛋白 大细胞单克隆性表 达 同一细胞同时表达 κ和λ轻链
CD30 一般阴性 一般阳性
CD15 一般阴性 一般阳性
EMA 有时阳性 一般阴性
*两者的背景均富于T细胞
2.3 淋巴细胞减少型(lymphocyte depletion, HDLD)
2.3.1 组织学特点和鉴别诊断 在WHO的分类草案中称为具有间变性大细胞淋巴瘤和霍奇金病特点的恶性淋巴瘤。此型占全部霍奇金病的5%以下。包括两种形态学变体,在Lukes分类中称为“弥漫纤维化型”和“网状细胞型”。在弥漫纤维化型,由于大量的非双折光性网状纤维的增加和无定形蛋白物质的沉积,淋巴细胞和其他细胞的数量极度减少。诊断性R-S细胞罕见,坏死明显。网状细胞型(即“霍奇金肉瘤”)的特点是细胞丰富。在非典型的单个核细胞其他成分背景中有大量的诊断性R-S细胞和多型性R-S细胞。成熟淋巴细胞、嗜酸粒细胞、浆细胞、中性粒细胞和组织细胞少见。坏死区较其他类型霍奇金病更为广泛。“网状细胞型”霍奇金病在鉴别诊断上应与大细胞性非霍奇金淋巴瘤(尤其是大细胞间变性淋巴瘤,表4),以及合体细胞性的结节硬化型相区别。HDLD病人的预后不良,80%的病人存活少于3年。
化疗对有的病人有效。
2.3.2 对于淋巴细胞减少型霍奇金病的再评价 随着对各种非霍奇金淋巴瘤,尤其是周围T细胞淋巴瘤和间变性大细胞淋巴瘤的认识,现在HDLD的诊断越来越少。对于过去诊断为HDLD的病例的再评价(包括形态学和免疫组化等)显示大多数病例被再分类为:(1)HDNSⅡ级(即NS中的淋巴细胞减少型);(2)大细胞淋巴瘤,通常是大细胞间变性,周围T细胞性和富于T细胞的大B细胞淋巴瘤。真正的HDLD病例极为少见。如果切片上腔隙型R-S细胞明显并有硬化,无论R-S细胞及其变种的数量,均应当分型为HDNS而不是HDLD。“网状细胞型”的HDLD与大细胞淋巴瘤的界限不清。如果背景淋巴样细胞的异形性大,则支持非霍奇金淋巴瘤的诊断。要证实HDLD的诊断,需要做广泛的免疫组织化学染色才能确定。
3 淋巴细胞为主型霍奇金淋巴瘤(HDLP)
3.1 结节型淋巴细胞为主型(nodular lymphocyte predominance, N-LP)
3.1.1 组织学改变 淋巴结的结构部分或全部受累。病灶呈模糊的大而深染的结节性分布。有时结节性分布的病灶可非常明显,在鉴别诊断上要与滤泡性淋巴瘤区别。N-LP的结节在低倍镜下见细胞大小和染色较滤泡型淋巴瘤的结节更加不规则,结节内淋巴细胞和上皮样细胞的混合给人以“斑驳”的感觉。结节旁可有未累及的反应性淋巴组织存在。进行性转化的生发中心也可存在于结节旁。结节中主要细胞成分是小的B淋巴细胞,可伴有散在的上皮样细胞和良性组织细胞。具有高内皮细胞的毛细血管后静脉明显增生。嗜酸粒细胞、浆细胞和纤维化缺乏或偶尔见到。典型的R-S细胞难以发现或者缺乏,因此,N-LP的诊断并不需要找到典型的R-S细胞。而另一种R-S细胞的变体,L%26H细胞或称“爆米花”细胞(popcorn cell),常出现于结节中央的上皮样细胞附近,有时数量相当多。这种细胞的形态特点为细胞核皱折,多叶状,核仁小。偶尔见到的L%26H细胞主要出现在结节边缘,形成“花环”状改变。有时L%26H细胞增多,形成大片,类似于弥漫型大细胞淋巴瘤。如在淋巴细胞为主的背景中发现有相当数量典型的R-S细胞,则应诊断为富于淋巴细胞型的经典霍奇金病。
表4 大细胞间变性淋巴瘤和经典霍奇金病的免疫表型区别
大细胞间变性淋巴瘤 经典霍奇金病
白细胞共同抗原(CD45RB) 一般阳性 一般阴性
CD15 一般阴性 一般阳性
CD30 一般阳性 一般阳性
EMA(上皮膜抗原) 一般阳性 一般阳性
T细胞标记 60%左右病例阳性 一般阴性
B细胞标记 20%左右病例阳性 某些病例偶尔为 CD20阳性
BNH9 一般阳性 一般阴性
BNH9是识别
血型抗原H和Y决定簇的单克隆抗体
3.1.2 免疫学标记 L%26H细胞表达的全B细胞标记有CD19、CD20、CD22、CD74、CDw75和CD45RA,也表达
白细胞共同抗原(LCA, CD45RB)。而T细胞标记均为阴性。L%26H细胞还可表达CD30或EMA,一般不表达CD15。与Ig合成有关的蛋白(J链)在L%26H细胞中确实存在,而一般不表达Ig的重链和轻链。但有报道N-LP是κ轻链限制性表达的单克隆性B细胞肿瘤。尚未见到EB病毒和bcl-2蛋白过度表达的报道。
3.1.3 鉴别诊断 (1)进行性转化的生发中心(progressive transformation of germinal ceutre, PTGC)。PTGC是一种反应性的病变。形态改变为在滤泡反应性增生的背景中出现大的散在的深染结节。结节内以小淋巴细胞为主,伴以散在的生发中心细胞,结节不具有生发中心的外套层。由于PTGC和N-LP有相似的组织学特点,而且可见于同一淋巴结内,有的N-LP病人随访后出现PTGC,有少量的PTGC病人发展为N-LP。因此Poppema等首先提出结节型的淋巴细胞为主型的霍奇金病起源于淋巴结的B细胞区,并且是从进行性转化的生发中心过渡来的。对于怀疑为PTGC的病例应当排除N-LP之可能。(2)滤泡型淋巴瘤。N-LP的结节一般较滤泡型淋巴瘤大,主要由小淋巴细胞组成,而滤泡型淋巴瘤结节中的瘤细胞较大,核有裂或者不规则。免疫组织化学检测到bcl-2蛋白表达支持滤泡型淋巴瘤的诊断。临床上如病人年龄在40岁以下,滤泡型淋巴瘤的诊断要十分谨慎。(3)小淋巴细胞性淋巴瘤和CLL。小淋巴细胞性淋巴瘤一般呈弥漫性分布,可有假滤泡,不形成结节。瘤细胞小而一致,可伴有散在的个别副免疫母细胞。不伴有上皮样细胞反应,也见不到L%26H型R-S细胞。临床上小淋巴细胞性淋巴瘤和CLL病人年龄一般在40岁以上。(4)富于淋巴细胞的经典霍奇金淋巴瘤,常呈滤泡间浸润,有散在典型R-S细胞及其变种。大细胞为CD30+、CD15+、CD20-。
3.2 弥漫型淋巴细胞为主型霍奇金病(D-LP) Lukes和Butler分类中的弥漫性淋巴细胞和组织细胞型霍奇金病,现在看来至少是由两种实体组成的:(1)弥漫型副肉芽肿,由L%26H细胞、淋巴细胞以及组织细胞(上皮样细胞)混合组成,但失去结节生长方式。与N-LP相似,诊断性的R-S细胞难以找到。现在有人认为此型是从N-LP发展而来的。因为网状纤维染色和免疫组织化学染色可显示出在常规HE染色切片上看不到的结节。此型的临床过程尚未确定,大概与N-LP相似,也呈惰性。(2)富于淋巴细胞的经典霍奇金病,即Lennert分类中的富于淋巴细胞的混合细胞型。镜下见单核霍奇金细胞以及少量的诊断性R-S细胞散在分布于小淋巴细胞和组织细胞背景中。见不到或者仅有极少数L%26H细胞。免疫组化染色结果倾向于经典的霍奇金病而不支持N-LP。临床上也不象N-LP那样高复发,此型可进展为HDMC或HDLD。在新的WHO分类中命名为富于淋巴细胞的经典霍奇金淋巴瘤。
4 小结
对于霍奇金淋巴瘤分类的再认识还在继续中,如大细胞间变淋巴瘤和霍奇金淋巴瘤的关系,在新分类中如何处理HDLD中的弥漫纤维化亚型等等。目前使用的霍奇金病的Rye分型是有用的,但并不理想。各亚型的命名与相应的镜下改变之间的关系不够密切。例如,1例HDLP或HDMC的病例,如有纤维组织束出现,可能被诊断为HDNS;1例明显的HDLP可能会由于出现相当多的R-S细胞而被诊断为HDMC;HDLD中,淋巴细胞的数量越多,就越容易误为HDMC。新的REAL和WHO分类尚有一个为人认识的过程。
目前国内病理界对于霍奇金病的认识与国际水平尚有一定的差距,主要表现在:①切片质量不佳是诊断不明或者误诊的主要原因之一;②对于典型霍奇金病的诊断过于强调诊断性R-S细胞的作用,对于背景的认识不够;③对于结节性副肉芽种(HDLP-N)的认识较少:④对HDNS的细胞期和合体细胞性的认识不够等。要提高国内的淋巴瘤诊断水平,就应当与国际先进水平接轨。

