
FLT3(Fms-like tyrosine kinase,FMS样的酪氨酸激酶3)属于III型受体酪氨酸激酶(receptor tyrosine kinase III,RTKIII)家族成员,其表达于短期造血干细胞、祖细胞和树突状细胞表面(图1,绿色区域)[1]。
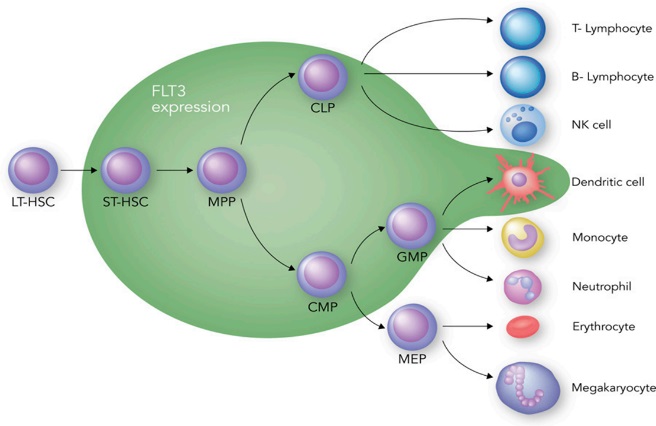
图1
约30%的急性髓系白血病(AML)患者伴随FLT3突变,且已被证实其与AML发生发展及不良预后密切相关。目前,已有多种针对FLT3分子靶点的小分子抑制剂(FLT3-TKI)被批准应用于临床或处于临床试验阶段。因此,深入了解FLT3的分子结构和功能对理解FLT3突变对AML疾病发生发展的影响和不同类型FLT3-TKI的临床应用有帮助作用。
一、FLT3的生理结构及功能
FLT3的编码基因位于13号染色体长臂1区2带2亚带,共97.3Kb,包含24个外显子(exon),转录为3842bp的RNA;FLT3分子由993个氨基酸组成,根据其功能依次为信号肽(SP)、Ig样区(Ig-like)、跨膜区(TM)、近膜区(JMD)、酪氨酸激酶1区(TKD1)、激酶插入区(KI)、酪氨酸激酶2区(TKD2)、C末端(CT)(图2)[2]。
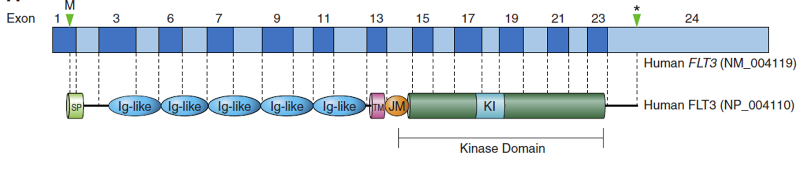
图2
FLT3分子经内质网上的核糖体翻译表达后,在高尔基体修饰成熟成为非激活状态的FLT3分子,并被转运至细胞膜(图3)[3]。此时的FLT3分子:JMD绑定由TKD构成的N-lobe和C-lobe保持非激活的空间构象,信号底物和ATP无法进入(图4)[4]。
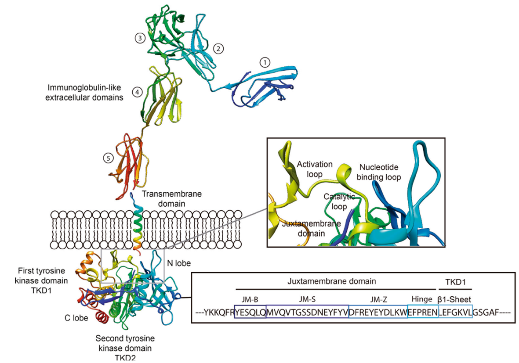
图3
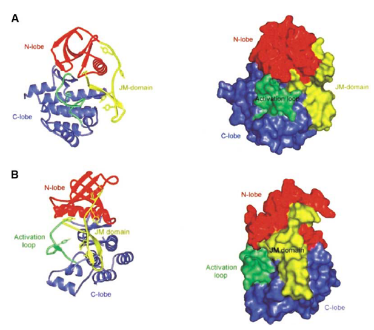
图4
FLT3的配体(FL)是造血干细胞生长因子家族成员,包括集落刺激因子-1(CSF-1)和干细胞因子(SCF)等。当FL同时与两个FLT3分子胞外第3个Ig样区结合后形成二聚体,FLT3分子进入激活状态(图5)[2];JMD(红色)解除对TKD的自抑制,A-Loop环(蓝色)构象由DFG-in变为DFG-out(DFG指A-loop环中的三个氨基酸残基asp-phee-gly),信号底物和ATP(黄色)分别进入TKD区域的结合位点(图6),多处TKD酪氨酸残基被ATP磷酸化而进一步磷酸化信号底物[5]。
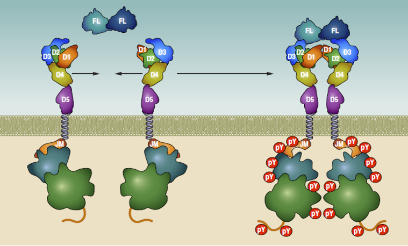
图5
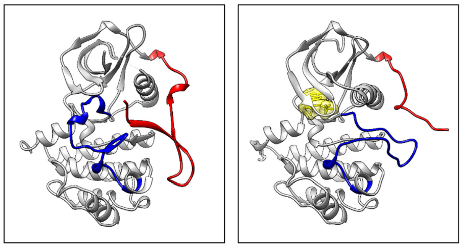
图6
综上,FLT3分子的生理活化经历四种状态变化(图7A)[5]:
(I)FLT3自抑制状态是通过JMD绑定TKD,将JM-B嵌入催化位点阻止ATP和信号底物进入来实现的。
(II)FL结合FLT3胞外区引起的JMD磷酸化,解除自抑制状态。此时FLT3已激活但仍处于非活化状态,ATP可以进入TKD区域的ATP结合位点。
(III)活化环(A-Loop)旋转DFG从“out”到“in”构象变化,不再阻止下游信号底物进入催化位点,此时FLT3处于活化状态。
(IV)磷酸化下游信号底物同时磷酸化A-Loop,稳定了DFG-in构象以维持FLT3一直处于活化状态。
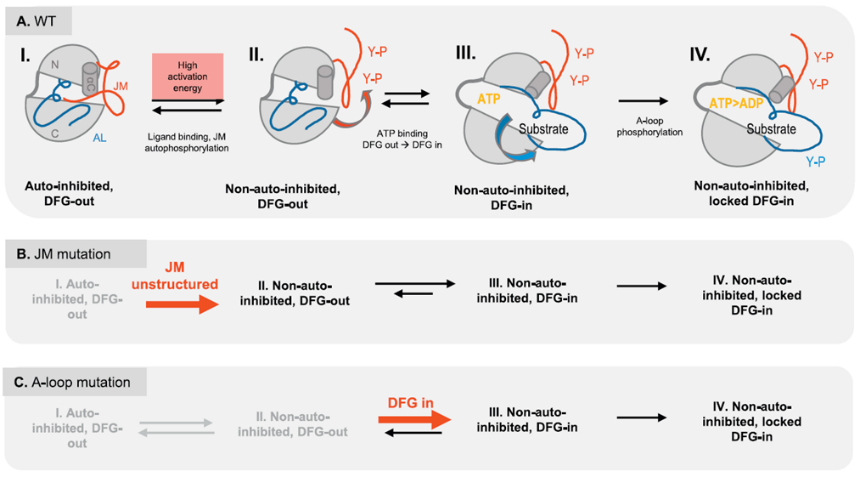
图7
FLT3磷酸化激活细胞内信号级联(RAS/RAF/MAPK、PI3K/AKT/mTOR和JAK/STAT)。这些通路调控细胞增殖、存活和凋亡(图8)[6]。
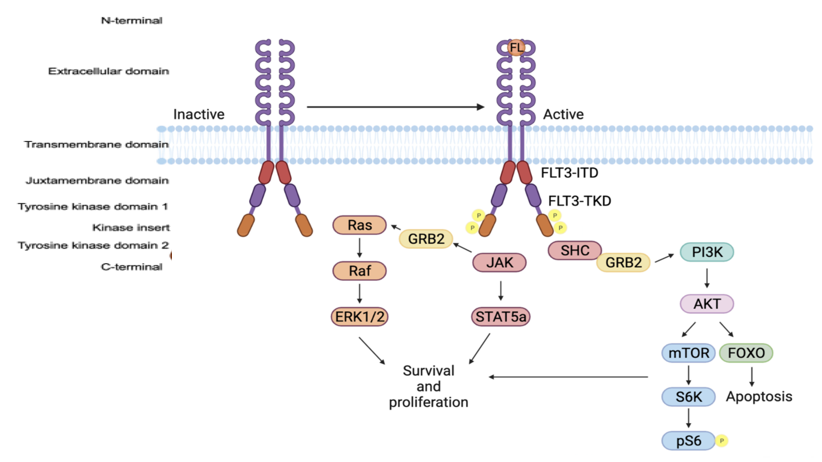
图8
二、FLT3的突变类型及其对FLT3活化的影响
FLT3-ITD突变:14/15外显子非移码插入3-1236bp碱基序列(3bp=1氨基酸),导致JMD插入一段长度不等的氨基酸序列,使JMD无法对TKD构成的N-lobe和C-lobe进行自抑制(图9,绿色云区)[7];JMD的非移码插入突变,破坏了JM-B嵌入催化位点的FLT3自抑制状态,导致FLT3分子非依赖FL激活(图7B)[4,5]。
FLT3-TKD突变:主要指发生在20外显子的碱基点突变,导致激酶区个别氨基酸的替换(图9,五角星区)[7];90.5%的TKD突变出现在TKD2的A-Loop环上(特别是D835/I836),会导致DFG-out构象不稳定非常容易变为DFG-in构象(图7C)[4,5]。
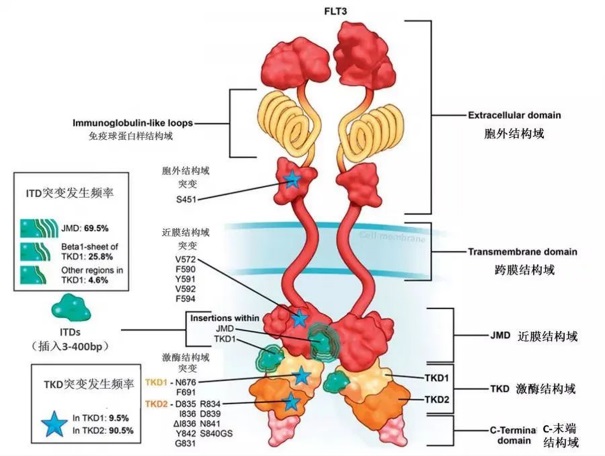
图9
三、FLT3-TKI分类及其差异
FLT3抑制剂的研究进程中,最初是将已有的具有FLT3抑制作用的TKIs拿来研究,评估其在临床试验中的疗效和安全性,这些TKIs被称为第一代FLT3抑制剂,包括Tandutinib、Lestautinib、舒尼替尼、米哚妥林、索拉非尼;由于第一代FLT3抑制剂最初并没有筛选对激活FLT3激酶的敏感性和选择性,因此,开发了更具选择性和抑制活性的第二代FLT3抑制剂,主要包括吉瑞替尼、奎扎替尼(Quizartinib)和Crenolanib(表1)[8]。
表1
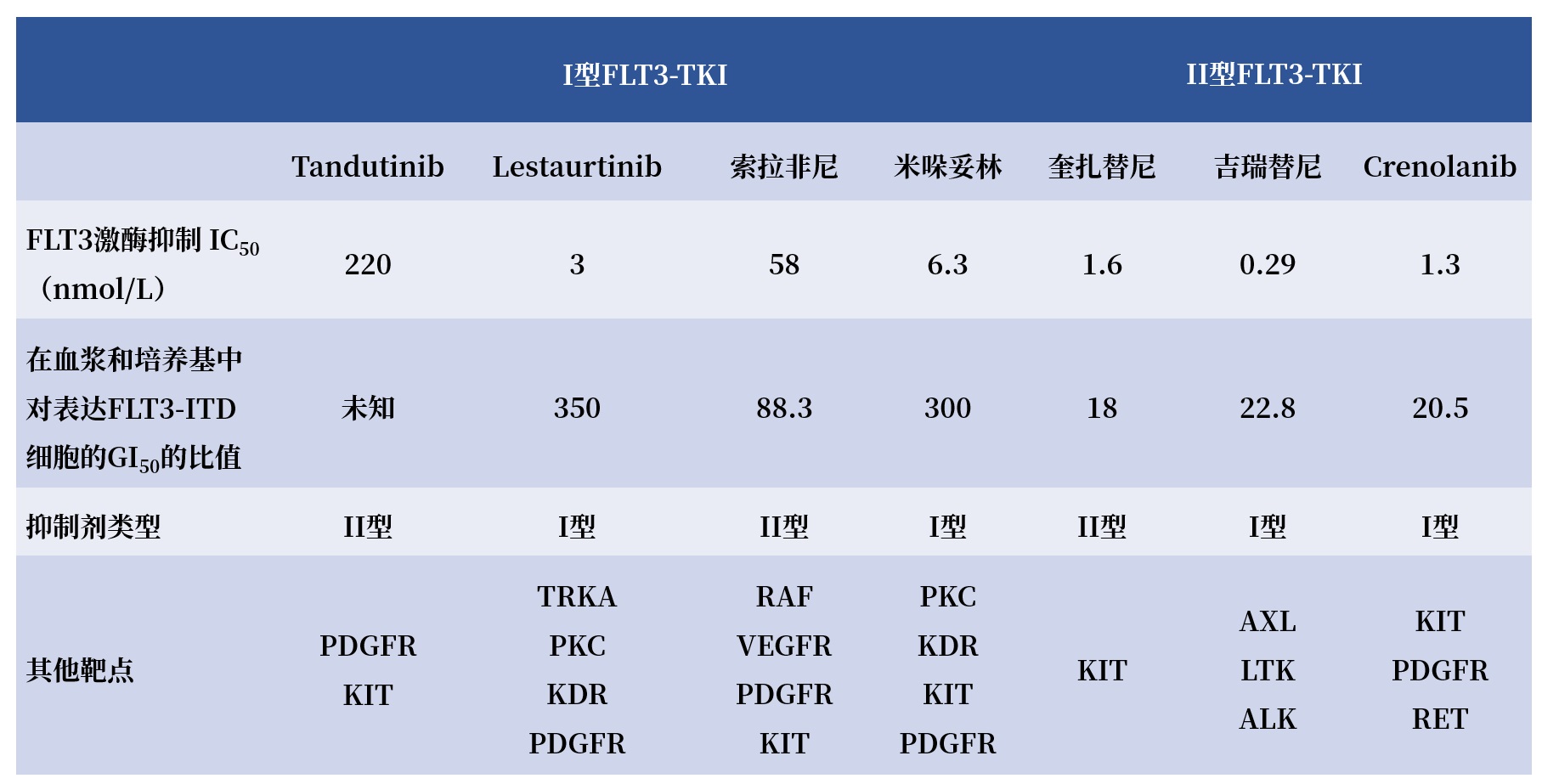
既往常用IC50评估药物的抑制活性,但IC50不能反映FLT3抑制剂的抑制活性,因为FLT3抑制剂在血中多与蛋白结合,导致发挥抑制作用的游离分子较少。研究显示,第一代FLT3在血浆中的GI50是培养基中的几十甚至几百倍,实际抑制活性较弱;第一代FLT3抑制剂均为多靶点抑制剂,容易造成脱靶效应,增加不良反应。
I型FLT3-TKI结合FLT3催化中心的ATP结合位点,并且不需要占据的底物结合区(图10B);II型FLT3-TKI结合FLT3需要占据ATP结合位点和催化中心的底物结合区,而FLT3在DFG-in状态下(活化构象)A-loop占据的底物结合区,阻止了II型FLT3-TKI结合FLT3(图10A)[5]。
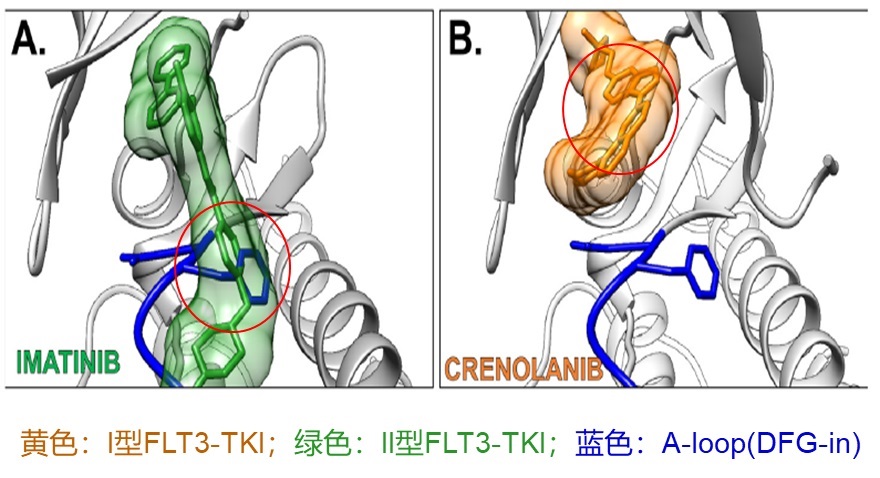
图10
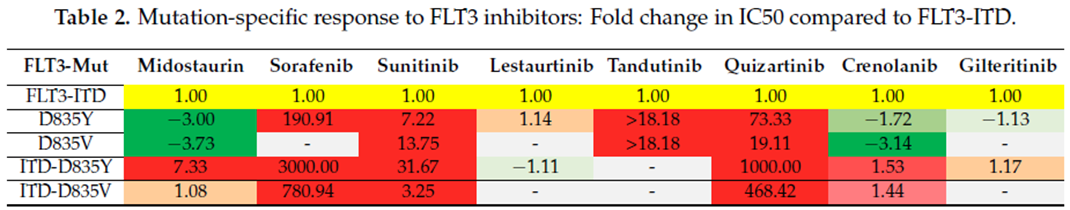
FLT3-ITD突变使JMD失去自抑制作用,不依赖FL而进入DFG-out向DFG-in转变的活化环节,提升磷酸化下游信号的FLT3分子数量;FLT3-TKD突变加速DFG-out向DFG-in转变,导致FLT3分子磷酸化下游信号能力增强;I型FLT3-TKI可以结合DFG-out和DFG-in状态的FLT3分子,对FLT3-ITD和FLT3-TKD带来的FLT3分子异常活化均有抑制作用;II型FLT3-TKI只可以结合DFG-out状态的FLT3分子,仅对FLT3-ITD带来的FLT3分子异常活化有抑制作用。这一现象在细胞抑制试验中也得到了证实(表2)[5]。
表2
FLT3-TKI已在国内临床实践中被广泛应用,但由于FLT3突变位点及类型的多样性,很多临床医生在不同类型的FLT3-TKI的选择中仍存在疑问,希望本文能从机制上给予解答。