
嵌合抗原受体T细胞(CAR-T细胞)疗法是指通过基因修饰技术将带有特异性抗原识别结构域及T细胞激活信号的遗传物质转入T细胞,使T细胞直接与肿瘤细胞表面的特异性抗原结合而被激活、增殖,从而发挥靶向杀伤肿瘤细胞的作用。2016年有研究者首次报道了抗B细胞成熟抗原(BCMA)CAR-T细胞治疗在复发难治性
CAR-T治疗MM与其他B细胞肿瘤有相似的细胞因子释放综合征(CRS)发生率,超过80%的患者发生3级及以上血液学毒性和几乎100%的免疫学毒性;但重度CRS和免疫效应细胞相关神经毒性综合征(ICANS)的发生率较其他B细胞肿瘤低。此外,MM常合并肾功能损害,并可合并心肌淀粉样变性,给CAR-T细胞治疗的安全性带来新的挑战。
考虑到CAR-T细胞治疗MM的快速发展和安全性,规范化的管理对于未来的临床试验和临床应用非常有必要。为此,中国医师协会血液科医师分会和中华医学会血液学分会共同编写了《嵌合抗原受体T细胞治疗多发性骨髓瘤中国血液临床专家共识(2022年版)》,旨在提高临床CAR-T细胞治疗MM的管理水平。医脉通将主要内容整理如下。
预处理
常用的预处理方案包括
CAR-T细胞输注的管理
1.CAR-T细胞输注前
CAR-T细胞输注前应进行感染的筛查、预防和管理。既往有中枢神经系统疾病或并发症的患者发生神经系统不良事件的风险会增加,建议待疾病控制后再行CAR-T细胞输注,同时可口服左乙拉西坦(750mg,每12h 1次)等药物预防
2.CAR-T细胞输注期间
预处理化疗结束后1~2d输注CAR-T细胞,最长不宜超过7d。商品化BCMA CAR-T ABECMA建议的输注剂量为(300~460)×106,CAR-T细胞输注的剂量与疗效和毒副作用相关,且不同的CAR-T细胞产品输注剂量差异很大。具体剂量要依据各产品前期预实验的推荐剂量。CAR-T细胞输注前开始进行生命体征监测,不推荐CAR-T细胞输注前予糖皮质激素预防过敏反应。
3.CAR-T细胞输注后
持续性监测生命体征至CRS症状消失,发生2级或以上CRS时,监护直至CRS分级降至≤1级或者根据患者的一般情况而定。CAR-T细胞输注后患者应住院观察,建议至少在医院密切监测7~14d。发生CRS时每天进行体格检查并监测
疗效评估
CAR-T细胞治疗后采用国际骨髓瘤工作组(IMWG)和《中国多发性骨髓瘤诊治指南(2022年修订)》进行疗效评估。
CAR-T细胞治疗相关毒副作用管理
1.CRS
MM患者CAR-T细胞治疗后CRS的发生率可高达90%,其中3~5级CRS发生率为5%左右。CRS的评估建议采用ASTCT评估标准。CRS的临床表现多样,与受累的组织器官有关,其中
表1 细胞因子释放综合征(CRS)分级评估指标及依据
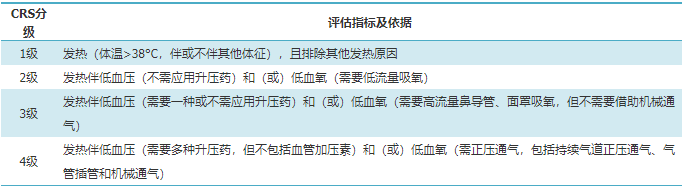
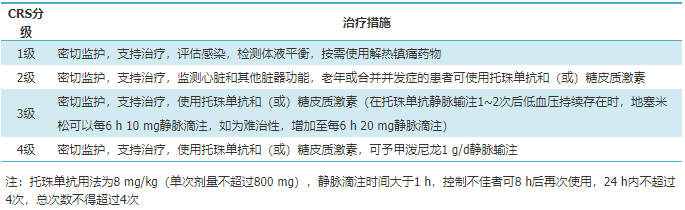
表2 细胞因子释放综合征(CRS)分级管理建议
2.神经毒性
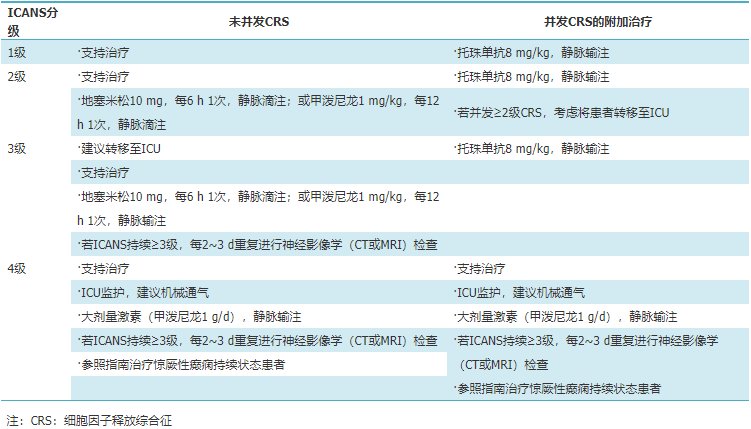
MM患者CAR-T细胞治疗后神经毒性的发生率为10%~42%,其中3级及以上的发生率为1%~3%。神经毒性表现多样,评估项目除意识、语言、书写外,根据需要及时行
表3 免疫效应细胞相关神经毒性综合征(ICANS)的分级管理
3.感染
感染是CAR-T细胞治疗中的重要并发症,常与CRS同时发生,病原体包括细菌、病毒、真菌、支原体及其他。CAR-T细胞治疗前需全面筛查(包括但不限于人类免疫缺陷病毒、丙型肝炎病毒、
4.B细胞缺乏和低免疫球蛋白血症
低免疫球蛋白血症是MM患者CAR-T细胞治疗后常见的并发症,BCMA单靶点治疗时几乎所有有效的患者发生低免疫球蛋白血症和B细胞缺乏。BCMA/CD19双靶点治疗时,低免疫球蛋白血症和B细胞缺乏发生率为100%,其中B细胞一般于CAR-T细胞输注后2个月逐渐恢复,IgM于3个月后开始恢复,而低IgA和IgG持续时间甚至超过1年,可能增加感染机会。CAR-T细胞治疗后3个月内应每月监测患者血清IgG水平,血清IgG<4 g/L者或血清IgG 4~6 g/L且并发感染者,应用丙种球蛋白替代治疗;血清IgG>6 g/L且并发感染者,建议进一步评估各型免疫球蛋白水平(IgG、IgA及IgM)和B细胞数量。
5.重要脏器损伤
CRS发生过程中常伴重要脏器功能受累和损伤,包括心脏、消化道、肝脏、肌肉、胰腺等,其中心脏受损和
6.骨髓抑制
MM患者CAR-T细胞治疗较其他B细胞肿瘤有更严重的骨髓抑制,KarMMa研究显示,3~4级粒细胞、血小板减少和
7.其他
其他治疗相关不良反应包括凝血功能异常、肿瘤溶解综合征、HLH/MAS等,具体可参照NCCN免疫治疗相关毒性管理和CAR-T细胞治疗毒性评估和管理。
CAR-T细胞治疗后维持治疗
到目前为止,CAR-T细胞治疗后是否应维持治疗或如何维持无基于循证医学的证据。维持治疗是CAR-T细胞未来一段时间重点探索的方向之一,包括
复发或进展后挽救性治疗
CAR-T细胞治疗后复发的治疗可参照《中国多发性骨髓瘤诊治指南(2022年修订)》,包括临床试验、既往敏感的药物和未使用的新药或新的联合治疗方案。二次CAR-T细胞治疗也值得临床尝试,但需要基于以下考虑:
①靶抗原阳性复发的患者,如首次接受鼠源性BCMA CAR-T复发后可选择人源化或全人源BCMA CAR-T或双靶点联合,也可选择其他可检测到的靶点;
②靶抗原表达降低复发可选择联合γ分泌酶抑制剂;
③对靶抗原阴性复发的患者,只能选择可检测到的其他靶抗原;
④更换不同共刺激分子的CAR-T细胞;
⑤对于CAR-T细胞在体内持续时间短或扩增差的患者,首先评估患者T细胞和CAR-T细胞功能或是否存在影响T细胞活性的因素,可延长洗脱期或尝试非自体CAR-T细胞。
随访
随访应包括以下三个方面内容:
①原发病持续缓解情况、远期不良反应及感染的防治。CAR-T细胞治疗后14 d和28 d,半年内每月评估一次,6~12个月每2个月评估一次,主要评估疾病的缓解状况和不良反应;
②第二年每3个月进行一次全面评估;第三年(及以后),每3~6个月或根据临床情况进行全面评估。评估的指标包括M蛋白定量、血清
③有髓外病变患者还需完善相关影像学检查,包括皮肤、软组织、淋巴结、肝、脾及中枢神经系统MRI,必要时行PET-
对于考虑疾病进展的患者应立即予以评估。此外,所有接受以病毒为载体制备CAR-T细胞治疗的患者,均需监测远期生物安全性。
本文摘自中国医师协会血液科医师分会, 中华医学会血液学分会. 嵌合抗原受体T细胞治疗多发性骨髓瘤中国血液临床专家共识(2022年版)