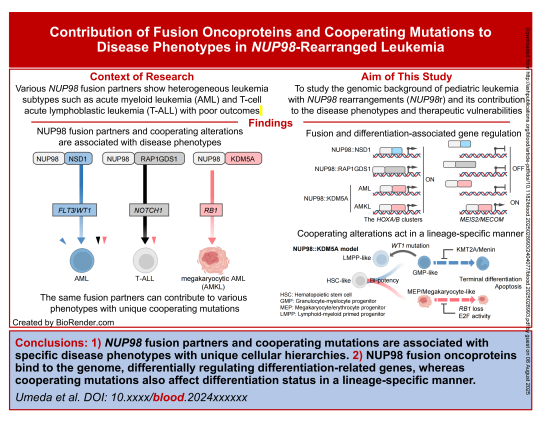
儿童急性髓系白血病(AML)预后不佳,部分归因于如NUP98重排(NUP98r)等治疗反应差的亚型。NUP98r与多种血液恶性肿瘤相关,不同融合伴侣有特定关联,但对其基因组特征与疾病表型的关系了解不足。虽已知NUP98融合癌蛋白结合基因位点,但多源于小鼠或非造血模型,缺乏人类模型及对分子机制的理解。因此,需开展全基因组研究,以揭示表型特异性突变谱,为开发基于生物学和分子机制的治疗策略奠定基础。
近日,由美国圣裘德儿童研究医院 Jeffery Klco 团队发表于 Blood 题为 Fusion Oncoproteins and Cooperating Mutations Define Disease Phenotypes in NUP98 Rearranged Leukemia 的文章,文章聚焦NUP98重排白血病,通过对177例相关白血病进行全基因组突变和转录分析等,探究其表型异质性机制。研究发现NUP98融合伴侣及协同突变与疾病表型相关,NUP98融合癌蛋白可调控分化相关基因,且协同突变也影响分化状态,同时揭示了细胞分化和协同突变对menin依赖性的影响,为治疗提供策略依据。

首先,本文探讨了儿童NUP98r白血病的转录异质性。在本文NUP98r白血病患者的队列中,急性髓系白血病(AML)是最主要的疾病类型(n=162),其次为T细胞急性淋巴细胞白血病(T-ALL,n=18)、治疗相关髓系肿瘤(t-MN,n=4)和骨髓增生异常综合征(MDS,n=1),反映出NUP98r血液系统肿瘤的异质性特征(图1A)。在融合伴侣基因中,NSD1出现频率最高,其次是KDM5A(图1B)。NUP98::KDM5A融合在婴儿患者中富集,而NUP98::NSD1及其他伴侣基因广泛存在于青少年及年轻成人患者中(图1C),这与既往报道的成人AML发病特征一致。转录组分析UMAP和无监督聚类分析显示,NUP98r恶性病变分布于其中6个聚类簇(图1D)。
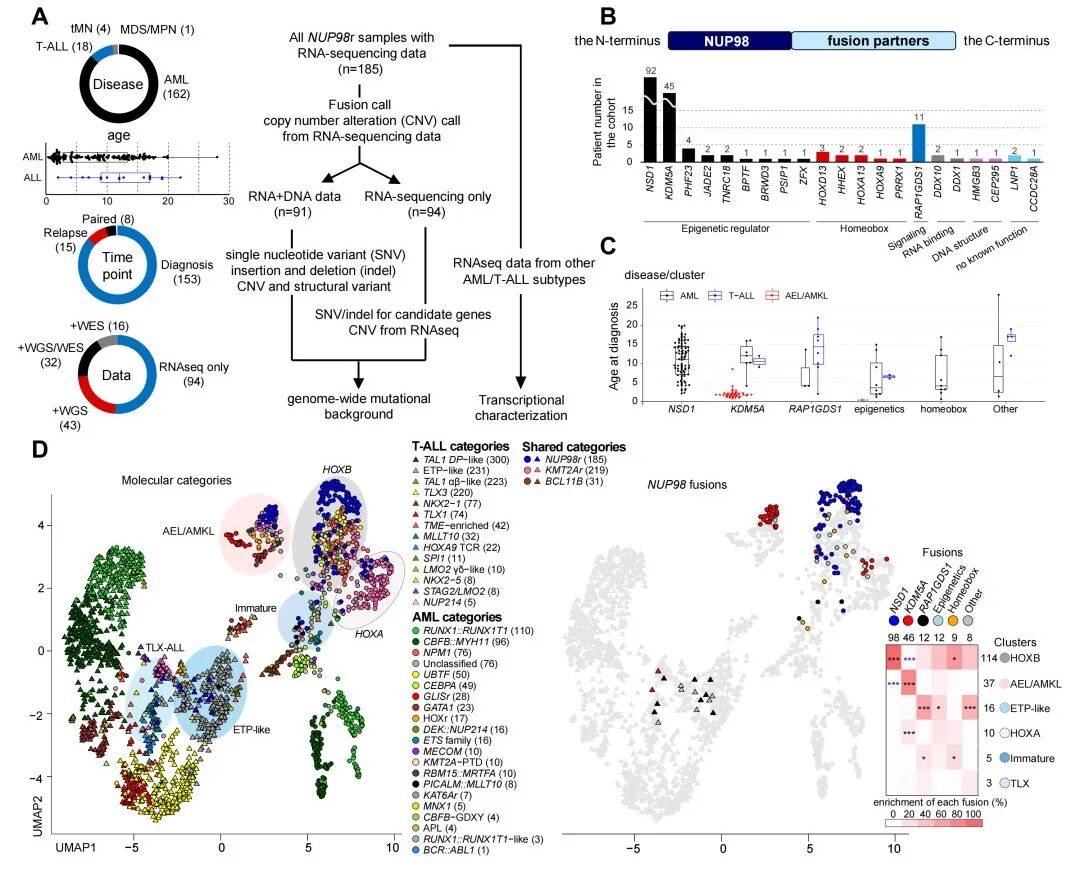
图1.儿童NUP98r白血病的异质性
然后,该研究评估了NUP98r白血病突变背景与疾病表型的关联。在53个高频突变基因中,最常见的是FLT3-ITD(n=70,37.8%),其次是WT1(n=44,23.8%)和NRAS突变(n=30,16.2%)。全基因组分析发现JAK2、GATA1和MPL突变与AEL/AMKL亚群相关,在非唐氏综合征AMKL中常见。FLT3-ITD与WT1基因在NUP98::NSD1型急性髓系白血病(AML)中呈现高度共现且富集特征(图2A-C)。FLT3-ITD与RAS通路相关突变较少共现,提示RAS突变可能存在于独立克隆或作为FLT3-ITD的亚克隆。对T-ALL/未成熟AML集群样本的突变谱分析显示,NOTCH1突变在ALL集群中富集,而IL7R突变在未成熟AML集群中富集(图2C)。这表明在未成熟NUP98重排白血病中,NOTCH1突变可能促进T-ALL表型的形成。这些数据共同揭示了NUP98重排恶性肿瘤中融合伴侣、协同突变与疾病表型间的关联。
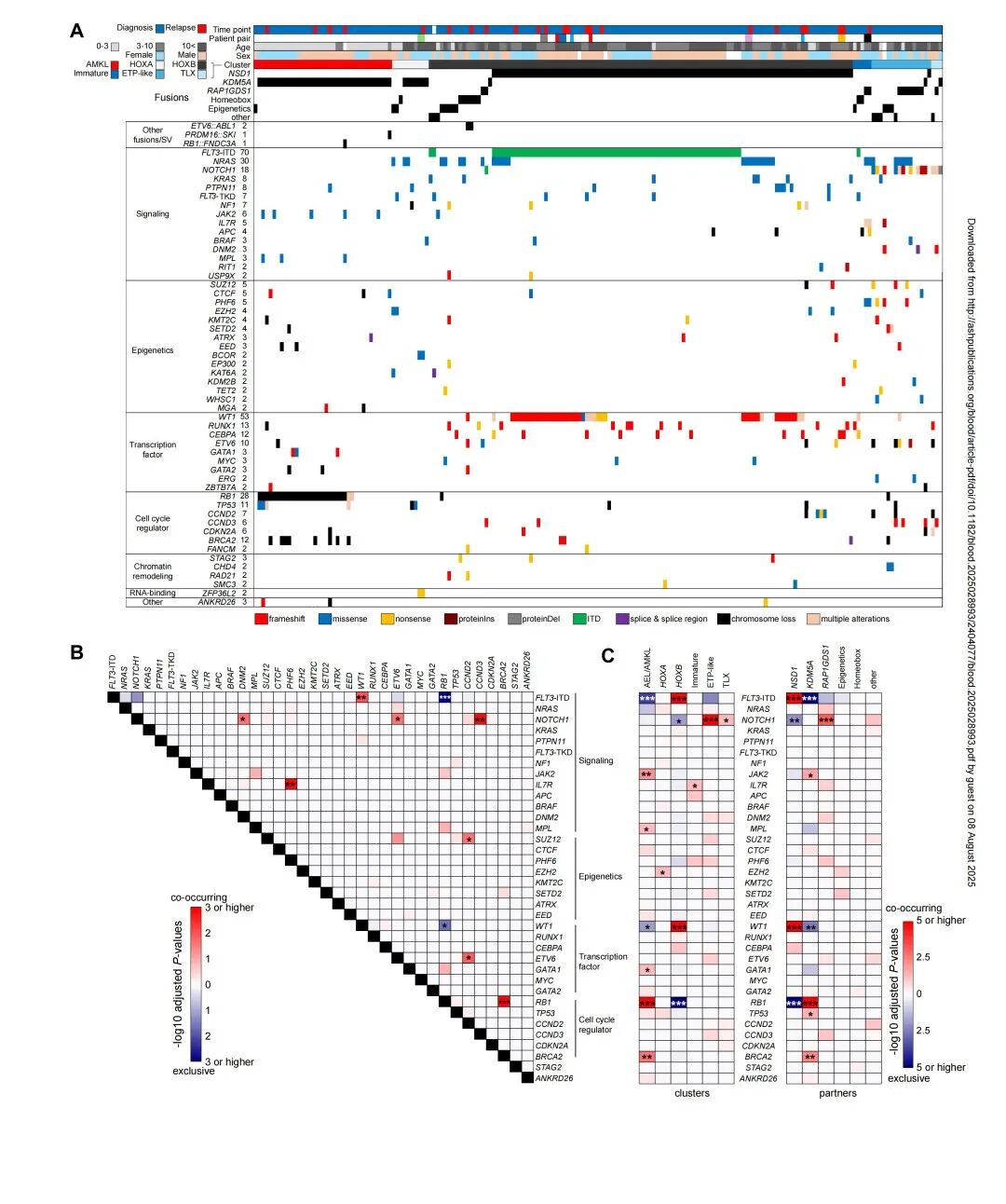
图2. NUP98r白血病突变背景与疾病表型的关联
接着,为探究NUP98重排(NUP98r)白血病的分化特征,该研究对9例携带典型融合基因(NUP98::NSD1、::KDM5A和::RAP1GDS1)的样本进行单细胞RNA测序,并获取了1例NUP98::NSD1 AML诊断-复发配对样本的公开数据(图3A)。UMAP分析显示各样本形成独立聚类,表明肿瘤具有独特的表达谱;而T细胞或B细胞聚类则包含来自多例患者的细胞,反映正常淋巴细胞特征(图3B-C)。 该研究还推断了与正常造血过程相对应的分化阶段,结果显示各样本中肿瘤细胞呈现特异性分布(图3D-F)。复发样本通常呈现低单核细胞特征与高淋巴髓系多能祖细胞(LMPP)特征,这表明在NUP98::NSD1型AML的亚群中,复发时存在干细胞样群体的扩增现象,该结果与其他亚型的报道结果一致。
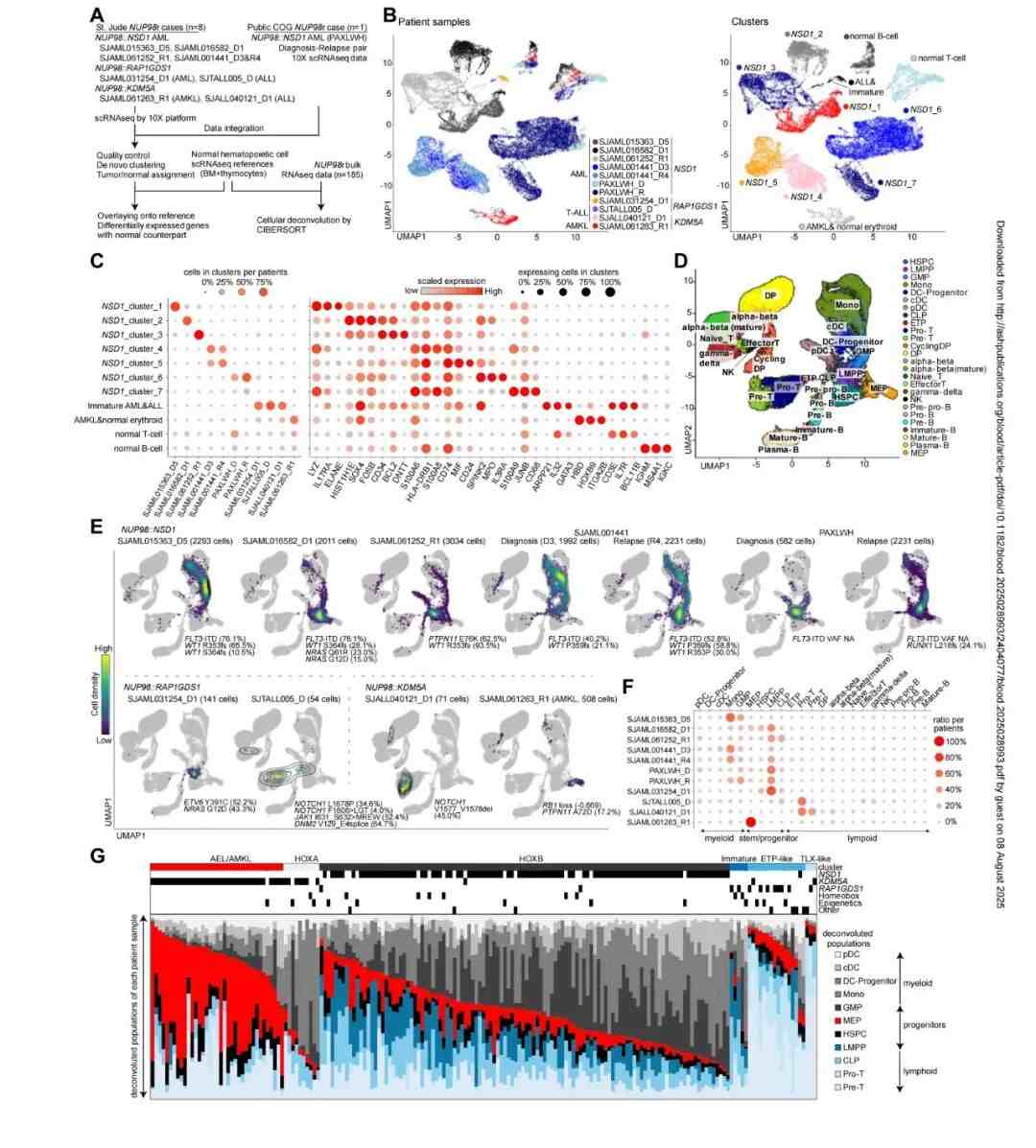
图3. 与融合及协同突变相关的NUP98r白血病细胞层级多样性
后续,该研究又通过脐血CD34模型重现NUP98r白血病的表型特征。NUP98融合癌基因的表达显著提高了甲基纤维素中的克隆形成能力,并增强了液体培养条件下的细胞增殖(图4A-C)。流式细胞分析显示其向巨核细胞谱系的分化倾向(图4D)。多时间点液体培养的RNA测序揭示了每种NUP98融合癌基因特有的转录状态动态变化(图4E-G)。与患者样本一致,NUP98融合癌基因转导组除HOXA/B基因上调外,还表现出TAL1和MYCN的高表达;而对照组则显示TAL1降低和ITGAM(CD11b)表达升高,提示髓系分化特征(图4F)。该研究鉴定出320个在NUP98融合癌基因组中共同高表达的基因,这些基因显著富集于同源盒基因家族(图4G)。值得注意的是,每种融合癌基因还特异性高表达与特定功能相关的基因,证实了NUP98::KDM5A阳性白血病的异质性(图4E-F)。
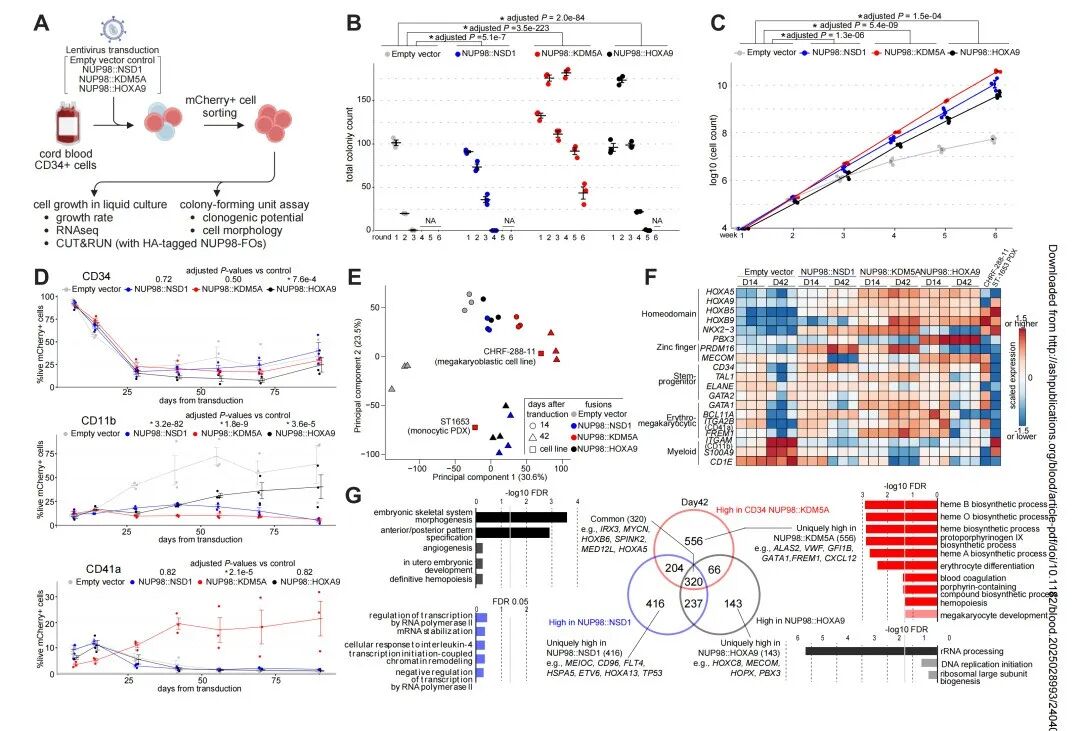
图4. 脐血CD34模型重现NUP98r白血病的表型特征
在NUP98融合癌蛋白的差异基因调控方面,研究显示,空载体对照细胞在HOXA/B基因簇仅显示微弱的H3K4me3和H3K27ac信号,这与观测到的低RNA表达水平一致(图5A)。对具有FO结合峰的蛋白质编码基因进行比较,发现三种NUP98-FOs存在97个共同靶基因(包括参与白血病发生和造血过程的基因如RUNX1、CDK6),同时每种FO还表现出特异性靶标和结合基序(图5B)。N-NUP98抗体揭示了各FO的靶基因即使在同一NUP98-FO组内也呈现异质性模式(图5D-E)。全基因组H3K27ac状态与疾病表型相关,而H3K27me3状态则与融合伴侣基因相关(图5F)。这些数据提示融合伴侣基因和细胞分化状态均可影响FO结合模式,从而在NUP98白血病中建立异质性的表观遗传和表达谱。
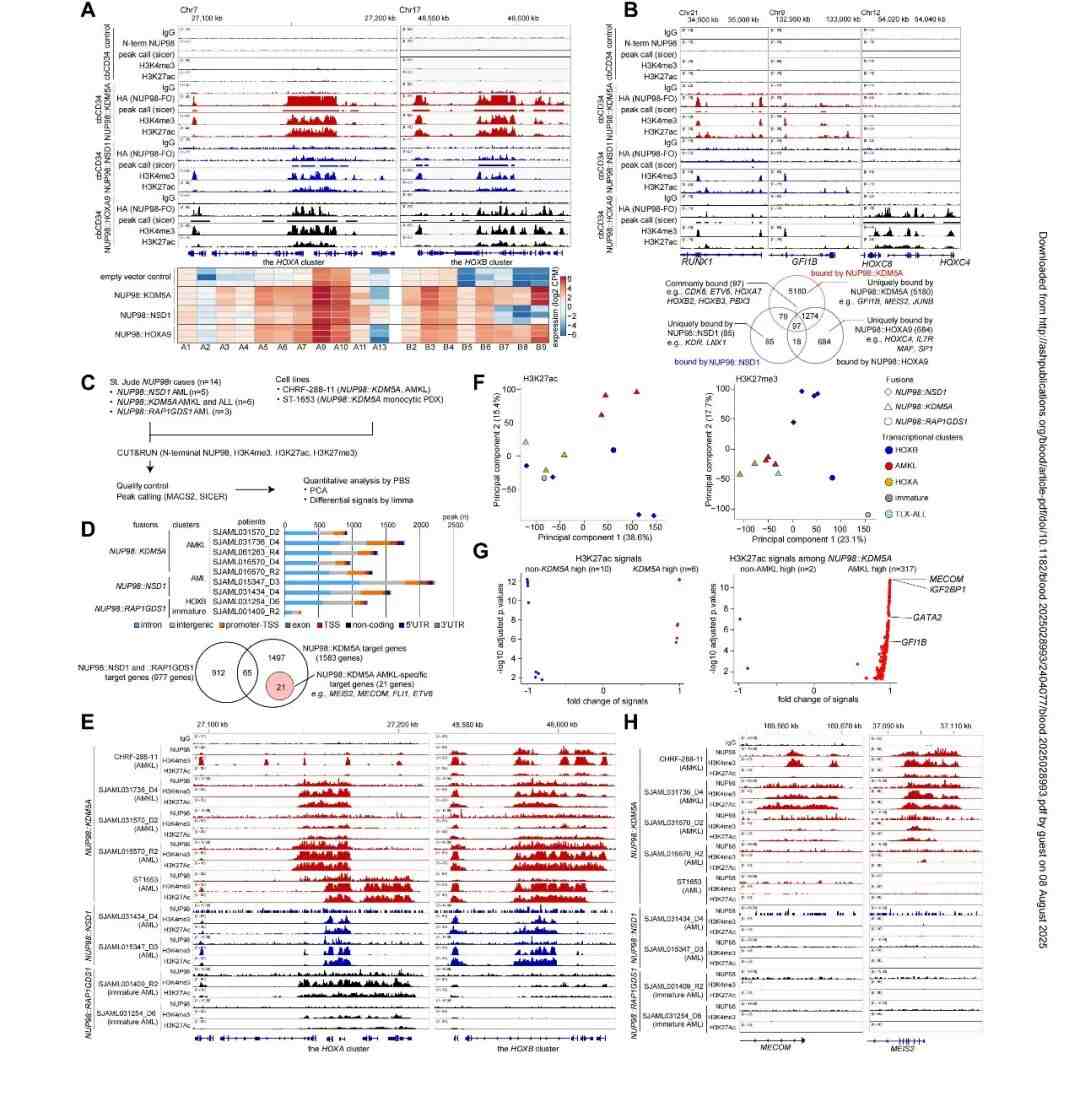
图5. NUP98融合癌蛋白的差异基因调控
接着,该研究对NUP98r白血病复发性体细胞突变的功能特征进行了分析。在NUP98::KDM5A cbCD34模型中,WT1 gRNAs显著促进细胞生长,而RB1缺失细胞具有生长优势(图6B-C)。形态学分析显示,RB1-gRNAs产生具有成熟巨核细胞特征的大细胞,WT1-gRNAs则富集均一性小原始样细胞(图6B)。流式细胞术表明RB1-gRNAs富集CD34+CD41a+细胞群,而WT1-gRNAs通过增加CD34+CD41a-细胞比例耗竭CD41a+群体(图6D)。与AAVS对照组相比,RB1-gRNAs导致CD34和RB1/E2F下游反馈调节因子CDKN2A上调,并改变免疫相关基因表达(图6F)。WT1-gRNAs同样增加CD34表达,同时伴随MHC II类分子上调及巨核细胞/血小板相关基因下调(图6G)。从这些条件中获得的ScRNAseg数据整体呈现出与正常造血过程相似的分化轨迹(图6H)。通过伪时序分析等证明,在NUP98::KDM5A模型中,RB1缺失会抑制血小板终末分化,导致细胞在类MK或类MEP阶段积累——这与E2F转基因小鼠中观察到的巨核细胞分化阻滞相似(图6M)。
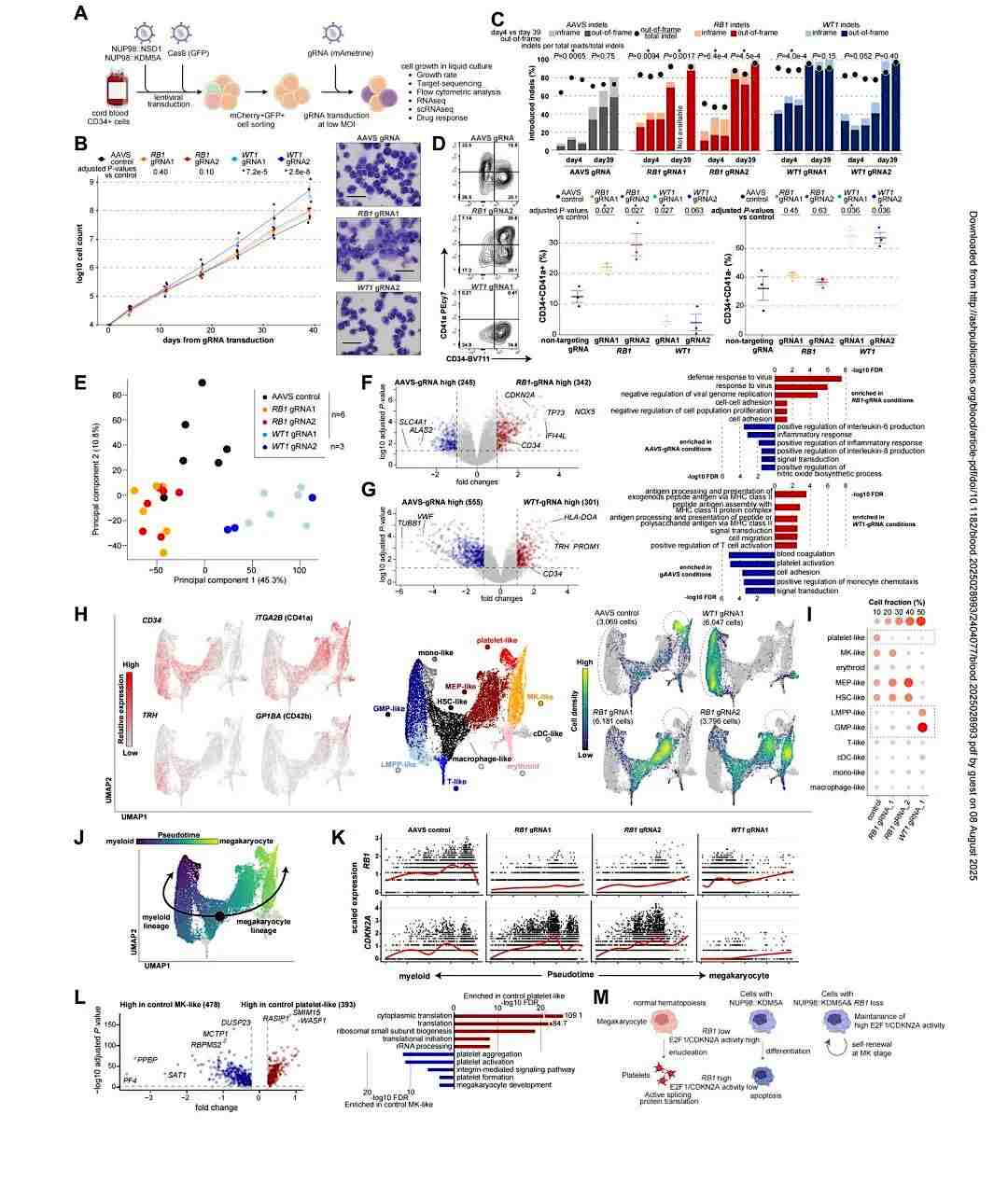
图6. NUP98r白血病复发性体细胞突变的功能特征分析
最后,该研究测试了协同突变与分化状态影响对menin抑制的敏感性。revumenib处理组在AAVS条件下显著抑制细胞生长,而RB1-gRNA或WT1-gRNA条件下的敏感性较低(图7B)。AAVS对照组和WT1-gRNA条件下CD11b+分化髓系群体显著增加,而RB1-gRNA条件下CD34+CD41a+群体增多(图7C),提示细胞层级发生适应性改变。ST1653对Menin抑制敏感而CHRF-288-11不敏感,进一步证实分化状态与Menin依赖性相关(图7E)。这些综合数据表明,细胞分化状态和协同突变均可影响NUP98重组白血病的Menin依赖性(图7F)。
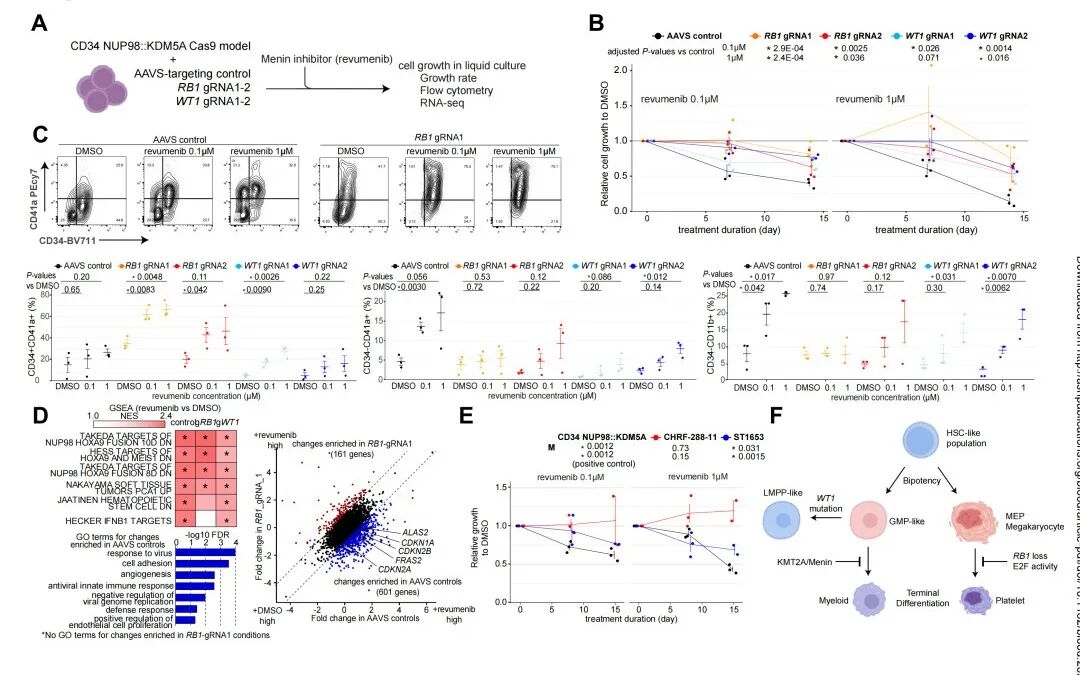
图7. 协同突变与分化状态影响对menin抑制的敏感性
总之,该研究通过整合多组学技术揭示了 NUP98融合伴侣基因与协同突变与特定的疾病表型相关,这些表型具有独特的细胞层级结构。NUP98融合癌蛋白通过与基因组结合,差异性调控分化相关基因;而协同突变则以谱系特异性方式进一步影响分化状态。细胞分化状态决定了阶段特异性的menin依赖性和耐药机制,这为未来NUP98重排白血病的治疗策略提供了新方向。