
急性髓系白血病(AML)是一种由克隆造血细胞异常增殖引起的异质性疾病。AML是成人急性白血病中最常见的亚型,诊断中位年龄为68岁。既往研究表明,AML患者5年总生存(OS)率估计约为30%,不同年龄组之间差异很大,年轻患者可达到50%,但60岁以上患者低于10%。自2017年以来,美国食品药物监督管理局(FDA)批准11种新药或联合方案用于AML治疗,上述生存数据可能会随之提高(表1)。近年来,随着对AML克隆演变、疾病进展和耐药机制的分子学深入研究,极大地提高了AML的精准诊疗。
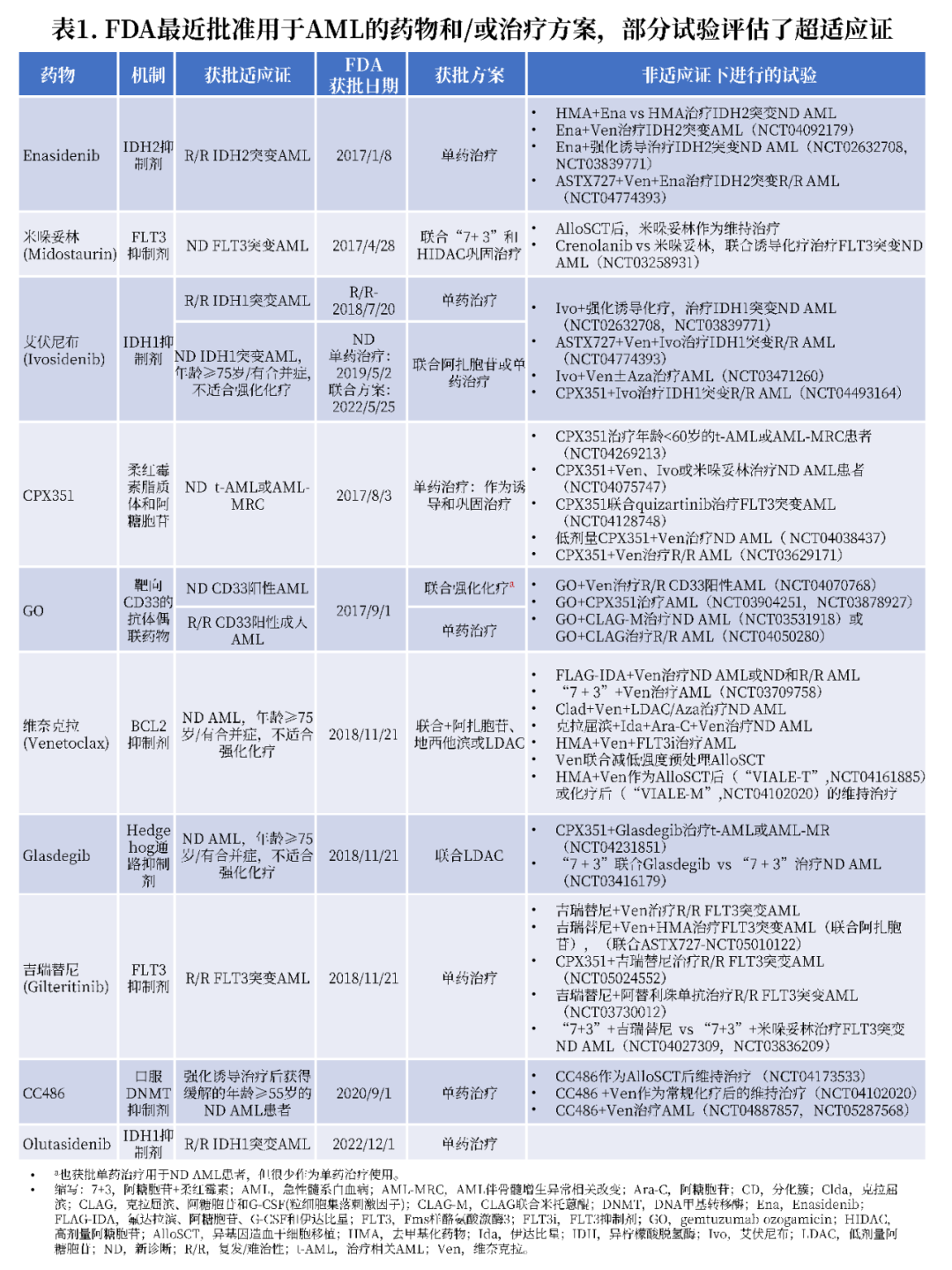
2022年,世界卫生组织(WHO)和国际共识分类标准(ICC)分别发布和更新了新的AML分类系统。欧洲白血病网(ELN)AML指南随后就AML诊断、风险分层、疗效标准以及治疗推荐进行了更新。美国丹娜法伯癌症研究所肿瘤内科的专家团队结合上述分类系统和指南更新,综述了2023年AML诊断、分类和治疗方案等的内容,哈尔滨血液病肿瘤研究所马军教授对该文章的内容进行了整理和解读。
诊断的更新
2022年,WHO和ICC分别发布和更新了新的AML分类系统,两者均基于AML病理生理学的新发现,并强调将分子学分析融入AML的临床实践中。
由于急性早幼粒细胞白血病(APL)是一种独特的临床病理学AML亚型,因此,该文章中AML均指非APL AML。
WHO和ICC均拓宽了特定AML亚型的遗传异常的定义,将NPM1突变确认为AML的一种亚型。另外,WHO现在将双等位基因突变或单等位基因框内碱性亮氨酸拉链区(bZIP)CEBPA突变定义为AML的一个亚型,而ICC仅确定存在bZIP CEBPA突变的AML为一个亚型。AML伴BCR::ABL1被正式定义为AML亚型,要求原始细胞≥20%,而不是≥10%,以区分加速期慢性髓系白血病(CML)。
WHO和ICC在特定情况下使用不同的原始细胞阈值来定义AML(图1)。两种分类系统均未纳入AML伴骨髓增生异常相关改变(MRC)的定义,反而引入了细胞遗传学和分子学异常进行分类,这些异常定义了功能性继发性个体发育,并与不良预后相关。此外,在这两种分类中,定义MDS的细胞遗传学和分子学异常略有不同。例如,在ICC中,RUNX1突变可定义骨髓增生异常,而在WHO中,它不能定义骨髓增生异常(图1和表2)。
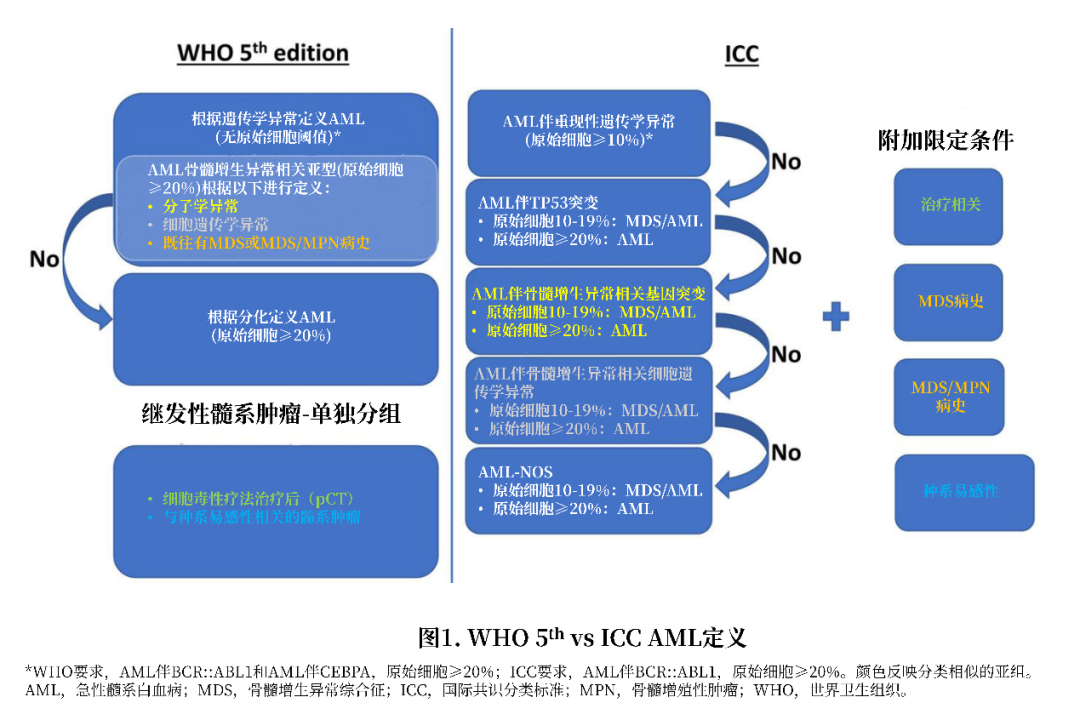
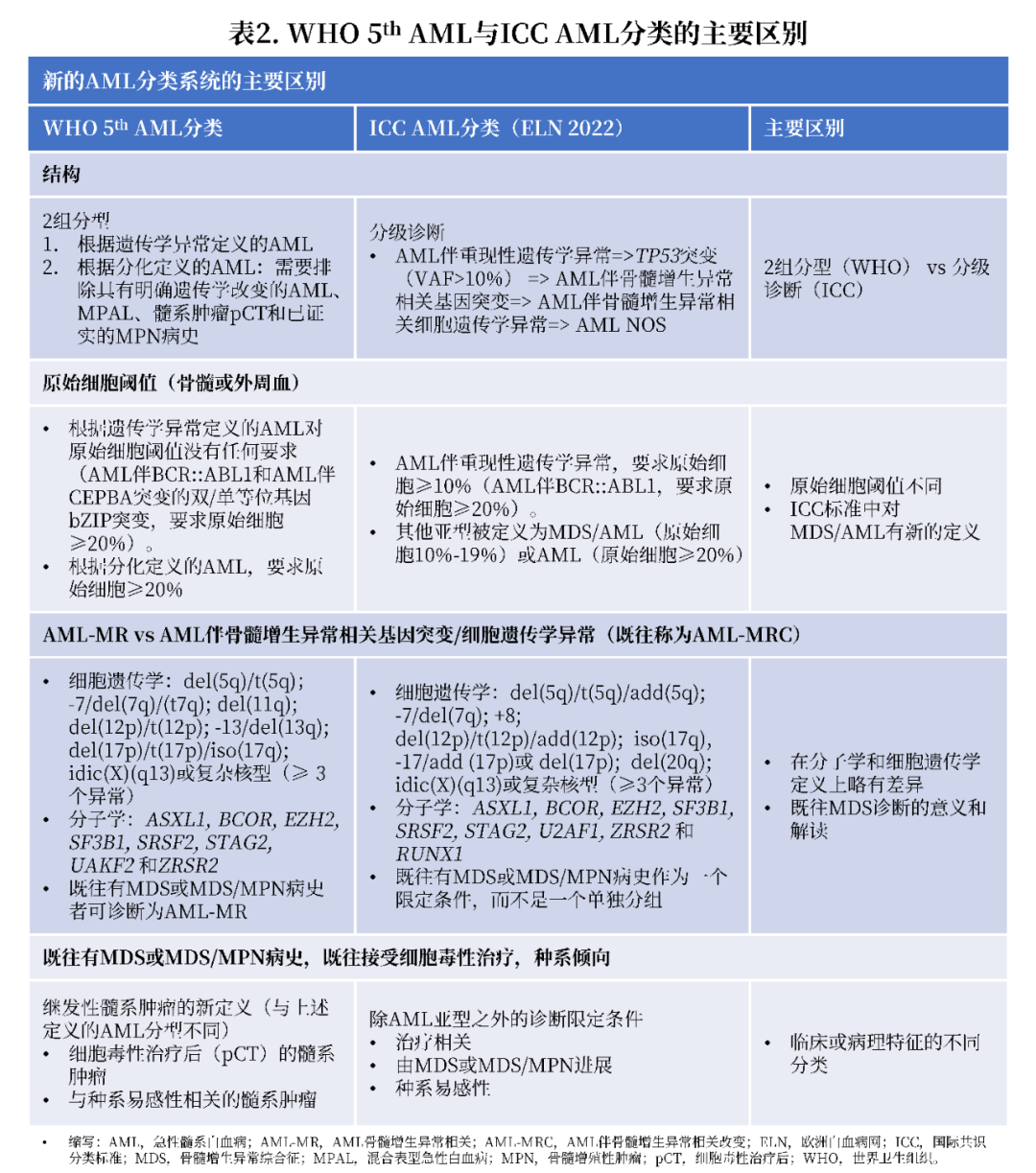
两种分类系统都特别考虑了既往接受细胞毒性药物治疗和种系易感性AML患者。在WHO分类中,这些肿瘤被重新归类为一个新的亚型,即继发性髓系肿瘤,包括在细胞毒性药物治疗后发生的或具有确定的种系易感性髓系肿瘤。在ICC分类中,这些肿瘤没有被单独划分类别,而是作为AML诊断的附加限定条件(图1)。
虽然AML诊断方面的进展有助于为每个亚型的患者优化最佳治疗策略,但两种新的分类系统对医护人员(尤其是病理学家)、临床医生和患者之间的沟通带来了更大的挑战。但是无论如何,临床医生仍然有责任结合所有数据来做出治疗决策。另外,ICC建议分子学检测的报告时间为3-5天,但这一目标对于许多检测中心来说较难实现。然而,对于几乎所有AML患者来说,等待一周再做出治疗决策是可取且安全的。
危险度分层的更新
最近发布了2022版ELN指南,其中对2017版的危险度分层进行了更新(表3)。该指南主要基于接受强化疗的患者,因此未来可能需要对接受非强化疗(包括以维奈克拉为基础的治疗方案)的患者进行调整。更新要点如下:
1.在风险分类中不再考虑FLT3-ITD等位基因频率,无论等位基因比率是高还是低或NPM1突变是否同时存在,所有具有FLT3-ITD的AML都被归类为中危组。
2.无论是否存在骨髓增生异常相关细胞遗传学异常,伴有骨髓增生异常相关基因突变的AML被归类为高危组,这类骨基因突变包括ASXL1、BCOR、EZH2、RUNX1、SF3B1、SRSF2、STAG2、U2AF1或ZRSR2。
3.NPM1突变AML如果伴高危细胞遗传学异常则被定义为预后不良。
4.CEBPA bZIP框内突变被归类为预后良好组,无论是双等位还是单等位基因突变。
5.某些疾病特异性细胞遗传学异常被纳入高危组,包括涉及MECOM基因的t(3q26.2;v)、或与KAT6A::CREBBP融合基因相关的t(8;16)(p11.2;p13.3)。
6.具有多重三体(或多体)的超二倍体核型不再被视为复杂核型和高危组。

MRD监测和评估
目前,监测微小残留病灶(MRD)最常用的两种技术是多参数流式细胞术(MFC)和实时定量聚合酶链反应(RT-qPCR)。二代测序(NGS)技术和数字聚合酶链反应(ddPCR)也可用于MRD评估,但这两种技术目前还处于研究阶段。
MRD的预后价值已在接受强化疗和较低强度化疗的患者中得到证实。虽然研究数据相对有限,但在未接受强化疗的患者中,MRD作为预后标志物的价值也已得到证实。另外,有研究表明NGS-MRD可作为移植前的预后标志物。
目前,ELN指南建议,NPM1或核结合因子(CBF)相关突变AML患者可使用qPCR监测(但也可用ddPCR或NGS替代)。其他所有患者,可以使用MFC-MRD确定患者的特异性白血病相关免疫表型(LAIP)(在某些情况下,可辅助使用错误校正的NGS-MRD)。一般情况下,AML诊断首选骨髓穿刺,但对于NPM1或CBF突变的AML患者,如果外周血原始细胞≥20%,则可以采集外周血确诊。治疗2个疗程后,应采集骨髓样本进行第一次MRD评估(NPM1和CBF突变AML患者可进行外周血评估)。治疗结束时,也推荐采集骨髓MRD评估。对于NPM1或CBF突变AML,为了在形态学复发前预测复发,建议每4-6周采集外周血或每3个月采集骨髓进行评估。MFC-MRD应在相对固定的抗体组合进行监测,但目前缺乏对于间隔时间的支持数据,因此专家组将其定义为探索性建议。
目前还不确定MRD是否可以作为一种辅助治疗决策的预测工具,但有前瞻性研究证明,RUNX1::RUNX1T1 AML患者的MRD对二次巩固治疗后的异基因造血干细胞移植(AlloSCT)决策有预测价值。此外,MRD阴性并不是疾病治愈的必要条件,约30%的MRD阴性患者会复发,而且并非所有MRD阳性患者均会复发,尤其是低水平PCR-MRD伴NPM1或CBF突变的患者。因此,在临床实践中,可将MRD作为一种辅助指标,而不能作为决策的唯一参数。
疗效和预后评估
2022版ELN指南疗效评估在完全缓解(CR)、完全缓解伴血液学不完全恢复(CRi)、部分缓解(PR)和形态学无白血病状态(MLFS)的基础上,增加了CR伴部分血液学恢复(CRh)的新概念,定义为骨髓原始细胞<5%、无外周血原始细胞或髓外病变、绝对中性粒细胞计数(ANC)≥500/μL和血小板≥50000/μL的部分血液学计数恢复。同时在MRD阴性CR(CRMRD-)的基础上,增加了MRD阴性CRh(CRhMRD-)和MRD阴性CRi(CRiMRD-)的指标。
复发的定义仍为骨髓原始细胞≥5%,或在至少间隔一周的≥2个外周血样本中再次出现原始细胞或发生髓外病变。MRD失败或复发的新定义:在4周内对同一组织来源(最好是骨髓)的2份连续样本进行检测,(1)通过任何方法检测MRD从阴性转为阳性;或(2)通过qPCR检测拷贝数增加超过10倍,满足上述条件之一则定义为MRD失败或复发。
单药和联合治疗的更新
年轻且没有严重合并症的患者被认为“fit(适合)”强化疗,年龄≥75岁是强化疗的相对禁忌症(特别是在已有有效低强度化疗可用的情况下)。FDA已批准一套筛选不适合接受强化治疗患者的严格标准(肝脏、肾脏、心脏、肺功能差)。然而,即使是“fit”患者(任何年龄)也可能不适合进行强化治疗,例如高危患者。
治疗AML的首要目标是实现CR,将白血病负荷降低几个数量级,然后进行缓解后巩固治疗,巩固治疗可以是化疗,也可以是AlloSCT。诱导和缓解后治疗的选择需考虑多种因素,包括患者合并症、既往病史(包括既往髓系疾病和/或接受细胞毒性化疗)、AML细胞遗传学和分子学危险度、治疗后MRD状态,以及供体可用性和患者的治疗目标。
适合强化疗AML的诱导治疗更新
对于适合强化疗的患者,以蒽环类药物和阿糖胞苷为主,最常见的是“7+3”方案。其他诱导方案、包括CLAG-M、G-CLAM、IA、FLAG-IDA和lomustine-IA。
最近FDA批准了几种药物适合接受强化疗的新诊断(ND)AML患者(表1和图2),包括靶向CD33的抗体偶联药物(ADC)Gemtuzumab ozogamicin(GO)、FLT3抑制剂Midostaurin(米哚妥林)、CPX-351。此外,FLT3抑制剂Quizartinib、BCL2抑制剂Venetoclax(维奈克拉)、IDH1抑制剂Ivosidenib(艾伏尼布)和IDH2抑制剂Enasidenib等在接受强化疗ND AML患者中也有相关探索使用。
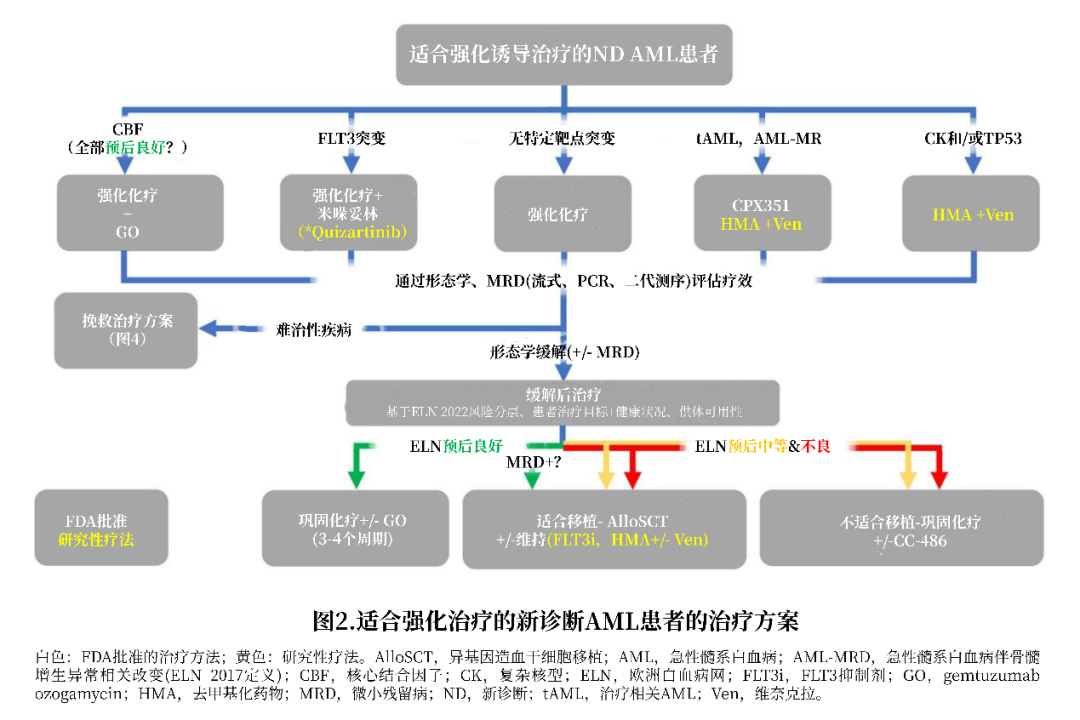
缓解后治疗的更新
患者达到CR后,为了获得良好的长期预后和可能治愈的机会,巩固治疗是必要的。通常ELN风险度分层中低危患者应接受3-4个疗程的大剂量化疗,而中危或高危患者建议继续接受AlloSCT。主要原因可能是复发/难治性(R/R)患者的死亡风险(在非低危患者中较高)高于AlloSCT治疗相关死亡(TRM)风险。
在首次CR1期间进行AlloSCT,高危AML患者获得长期生存的机会最大,但一项来自英国的研究表明,中危患者的最佳移植时间为CR2,因为可以避免许多(尤其是MRD阴性且复发几率相对较低的患者)移植相关的不必要的发病和死亡。笔者的做法是有供体且无禁忌症的条件下,所有中危和高危患者均在CR1期接受移植。得益于单倍体AlloSCT,几乎所有患者都可获得供体。
移植后维持治疗可能有助于延长生存。对于不能接受AlloSCT的细胞遗传学中危或高危AML患者,可以使用CC-486(“口服阿扎胞苷”)进行维持治疗。但是近年来,由于采用了耐受性更高的减低强度预处理方案,以及单倍体AlloSCT的预后改善,供者库更大,AlloSCT更容易开展。此外,AlloSCT常用于老年患者,其发病率和TRM较低。因此,CC-486的使用可能仅限于那些适合强化治疗但不适合移植的少数患者。
初诊AML的非强化疗更新
几年前,对于不适合强化疗的老年患者,我们主要采取支持性治疗,但预后不佳。最近一些药物和联合方案获批用于该人群,特别是在低剂量化疗中加入维奈克拉,彻底改变了该人群的治疗模式(表1和图3),并延长了患者生存期。此外,FDA批准IDH1抑制剂艾伏尼布、Hedgehog通路抑制剂Glasdegib用于该人群。IDH2抑制剂Enasidenib、FLT3抑制剂吉瑞替尼也在此人群中开展了相关研究。
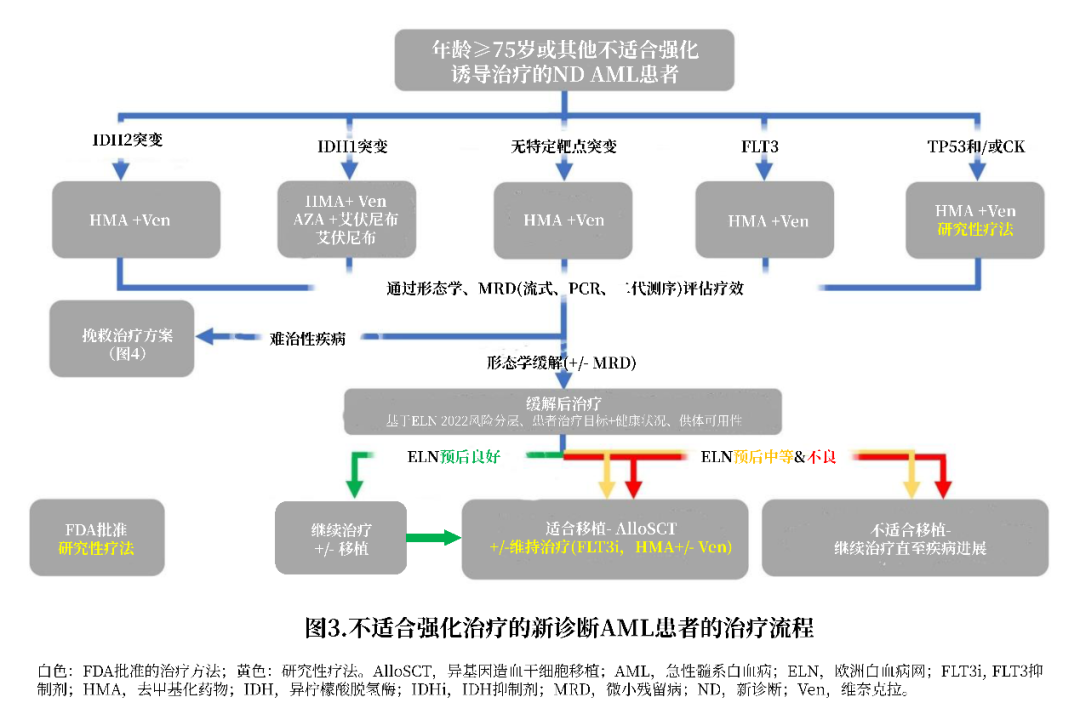
R/R AML治疗的更新
对R/R AML的治疗仍存在挑战,患者的5年生存率仅为10%。近年来,几种针对特定突变患者的靶向疗法获批用于R/R AML患者(表1和图4),包括FLT3抑制剂吉瑞替尼、IDH1抑制剂艾伏尼布和Olutasidenib、IDH2抑制剂Enasidenib和CD33-ADC GO。此外,维奈克拉联合强化化疗以改善R/R患者预后的相关研究也显示出良好的疗效。
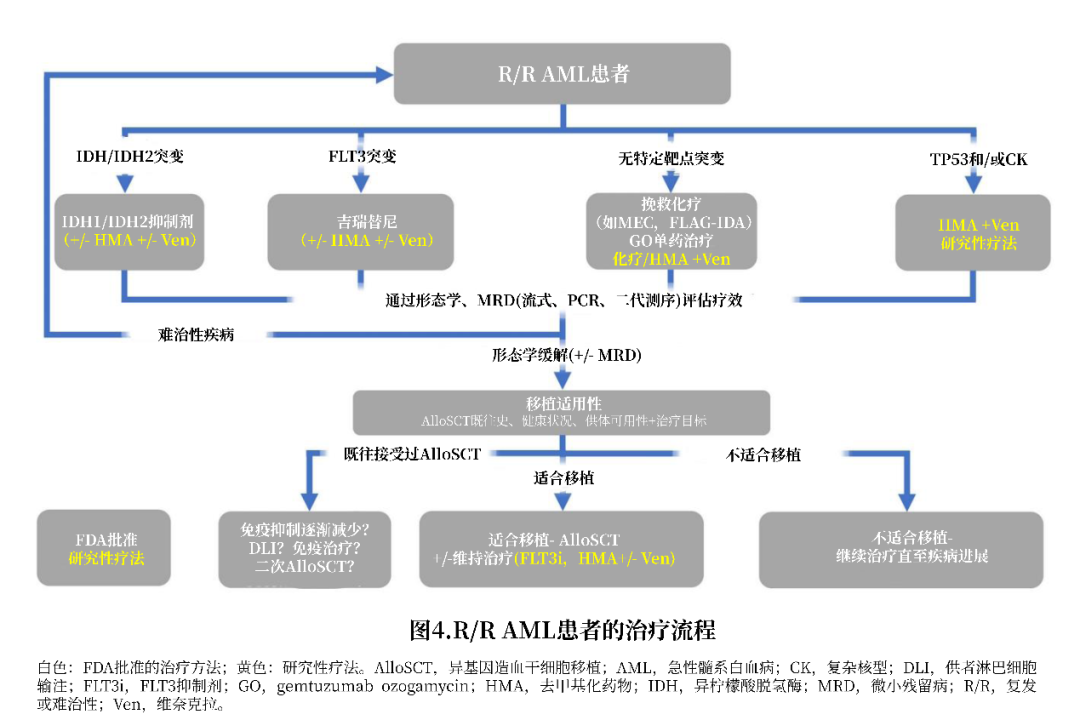
临床试验的更新
近年来,AML的疗效有了显著改善,但结果不尽如人意,尤其是高危患者。许多试验正在评估靶向疗法或免疫疗法作为单药治疗或联合疗法的疗效。尽管多数仍在研究中,还没有长期随访的结果发表,但一些研究已经显示出令人期待的早期疗效数据,即使是在AML伴TP53突变或AML伴MLL重排患者等具有挑战性的人群中(表4)。

治疗策略的更新
AML治疗的关键是判断患者是否适合强化疗方案以及是否会从治疗中获益(例如,TP53突变患者可能无法从强化疗方案中获益)。治疗决策主要基于患者年龄、合并症、治疗目标以及疾病特征,也基于医生的临床经验。
笔者提出了一些建议:
1.AML最常见的死亡原因是复发或难治;
2.年龄不应是治疗强度选择的唯一决定因素;
3.选择治疗策略时,应对合并症进行全面评估。AML引起的暂时性合并症不应成为接受强化疗的禁忌症;
4.对于老年患者,应进行年龄评估,并考虑适合患者的最佳治疗方案。尽管没有评估分类的标准,但年龄评估可以填补常规临床实践中未发现的漏洞,并可预测发病率和死亡率。年龄评估在接受低强度方案和强化治疗的老年患者中也具有预后价值,并有助于预测诱导治疗期间的非致死性毒性。在一项随机试验中,相比常规血液肿瘤会诊,邀请老年病学专家共同会诊具有较高的临终关怀和治疗目标讨论率,此外,63%-88%的临床医生认为与老年病学专家会诊是有获益的;
5.应尽早讨论治疗目标,并依此选择对患者的最佳治疗;
6.如果患者符合移植条件,则应予以考虑。这可能影响初始治疗(作为桥接移植或最终治疗)的决策;
7.某些AML亚型可能对不同的治疗方法产生不同的疗效(即,TP53突变AML对化疗疗效不佳,单核细胞分化患者对HMA+维奈克拉的疗效可能较差)。
总结
如今的AML治疗方案与10年前大相径庭。随着对病理生理学认识的不断深入,已有许多新药获批用于AML的治疗,对一些恶性髓系细胞检测能力的提高也改变了AML的诊疗现状。AML是一种高度异质性的疾病,需要针对患者进行个体化的诊疗,但目前仍有许多挑战和未满足的需求。AML已经进入了个体化治疗时代,我们需要加倍努力设计新的临床试验,通过小队列患者验证疗效,以期给患者带来更好的生存和预后。