
急性髓系白血病(AML)是最常见的白血病类型。美国SEER数据库2010年至2014年的数据显示,年龄调整后AML年发病率为4.2/10万。欧洲的流行病学调查显示年龄调整后AML年发病率为3.8/10万。AML的发病率随年龄增长而上升,45岁以上人群中上升尤为明显,SEER数据库1998年至2002年的数据显示在<65岁人群中年发病率为1.8/10万,而≥65岁者则增至16.3/10万。预计2017年美国新发AML患者达21 380例,占新发肿瘤的1.3%。
化疗、靶向药物和造血干细胞移植目前仍是AML治疗的主要手段。AML患者在临床表现和治疗预后方面呈现很大的异质性,因此在治疗前进行充分的危险度分层对于选择合理的治疗路径尤为重要。诱导治疗后、巩固治疗和随访期间进行规范的动态微小残留病(MRD)分析可早期发现临床复发的患者并及时干预,对于改善患者的预后极为重要。除了常规的预后分层因素外,近年来基因组测序技术在AML中的广泛应用为危险度分层和MRD监测提供了更为丰富和有效的分子标志,将对AML的精准治疗产生深远影响。
一、AML的危险度分层
影响AML患者预后的因素大体可以分为两类,患者相关的因素和AML细胞相关的因素。在患者相关的因素中,年龄是最为重要的独立预后因素。美国西南肿瘤组(SWOG)的一项临床研究显示,>60岁AML患者的完全缓解(CR)率仅有24%。与年轻患者相比,老年AML患者具有更多的不良预后因素,其造血干细胞老化更为明显,常伴随DNA损伤、端粒缩短与特殊的氧化应激状态。老年AML患者中,预后不良核型(如-5/5q-、-7/7q-、复杂核型、单体核型)比例更高,而预后良好核型比例更低。此外,高龄AML患者的基因突变特点也不同于年轻患者,一些不良预后的突变(如TP53、DNMT3A)的发生率明显增高。
机体的体能状态和合并疾病指数也是影响AML预后的重要因素,有些患者实际年龄和生理年龄不一定相符,部分高龄患者的身体状况较为理想,甚至可以接受较强的化疗和造血干细胞移植,而另一些患者可能年龄尚轻,但健康状态已不容乐观。目前已有多种对癌症患者或造血干细胞移植受者进行健康评价的积分体系。
影响预后的AML细胞相关因素包括患者的白细胞计数、形态学特点、免疫学特点、细胞遗传学特征及分子异常等。其中,AML细胞的细胞遗传学和分子遗传学特征是最重要的预后判断要素。50%~55%的AML患者经染色体显带分析可发现克隆性核型异常,不同的核型异常预示着不同的预后,如t(15;17)、t(8;21)和t(16;16)/inv(16)提示理想预后,复杂核型、单体核型、t(6;9)、inv(3)(q21q26)提示不良预后。
因此,根据核型结果可将AML分为预后良好、预后中等和预后差三个组别,对预测AML患者的预后有重要价值。在2016年最新修订的世界卫生组织(WHO)白血病分型建议中,伴有t(8;21)(q22;q22)、t(15;17)(q22;q21)、inv(16)(p13q22)/t(16;16)(p13;q22)、t(9;11)(p22;q23)、t(6;9)p23;q34)、inv(3)(q21q26.2)和t(1;22)(p13;q13)的AML被列为7种再现性的AML亚型。
近年来,随着新一代基因测序技术的广泛使用,在AML中发现了越来越多的分子异常,AML已成为分子背景描绘最为清晰的血液肿瘤类型。AML最常见的突变基因包括FLT3、NPM1、DNMT3A、N-RAS、TET2、IDH1/2、CEBPA、RUNX1、TP53等,不同基因突变之间及基因突变与核型异常有着复杂的共存或互排关系,如NPM1突变的AML患者中,54%可检出DNMT3A突变,39%可检出FLT3-ITD突变。一些分子异常已显示出明确的预后价值,如CEBPA双等位基因突变、NPM1突变且FLT3-ITD阴性或低水平提示良好预后,FLT3-ITD且NPM1野生型、RUNX1突变、ASXL1突变、TP53突变提示预后不良。在2016年修订的WHO白血病分型建议中,伴有NPM1突变的AML、伴有CEBPA双等位基因突变的AML作为两个亚类,伴有RUNX1突变的AML和BCR-ABL1阳性的AML成为两个新的暂定亚类。
如何将上述AML的预后影响因素结合起来,建立有效的综合分层体系是一个至关重要的问题。近年来已有相当多的临床研究尝试将分子异常与其他因素结合,初步结果显示可进一步提高对AML,尤其是中危组AML预后判断的准确性。在2017年欧洲白血病网络(ELN)的AML诊疗指南中,已将NPM1、FLT3-ITD、CEBPA、RUNX1、TP53、ASXL1等分子异常与核型异常结合,建立了有效的综合分层体系(表1)。相信随着临床数据的不断积累,AML的分层体系将越来越完善。
表1. 2017年欧洲白血病网络(ELN)急性髓系白血病危险度分层体系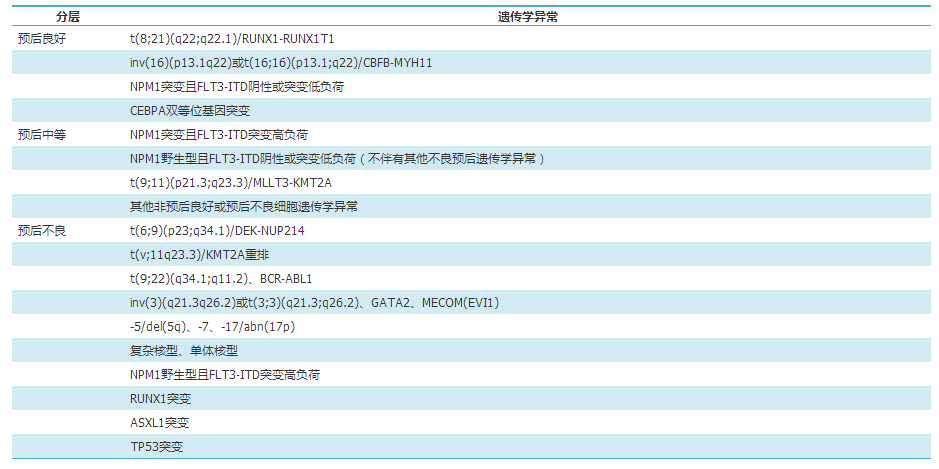
二、AML的MRD监测
MRD是指在白血病患者完全缓解后,体内残存少量白血病细胞的状态。MRD检测对于评估疾病状态、判断疗效、预测复发、早期干预具有重要临床意义,多参数流式细胞术(FCM)和荧光定量聚合酶链反应(PCR)技术的发展显著提高了MRD检测的敏感性和准确性。目前,多参数FCM和实时荧光定量PCR(RQ-PCR)技术也是AML患者MRD检测的主要工具。
AML患者MRD检测的标志包括4类:
(1)免疫标志:正常造血细胞在其分化不同阶段的抗原表达受一系列基因严密控制,在一定分化阶段哪些抗原表达及抗原表达量的多少存在着明显的规律性,AML细胞可出现白血病相关异常免疫表型(LAIP),可表现为非同步抗原同时表达、交叉抗原同时表达、抗原表达量异常、细胞表面与胞质内抗原同时表达及光散射信号改变等。FCM检测LAIP作为MRD标志适用于75%~85%的AML患者,敏感性在10-3~10-4,低于实时荧光定量PCR 1 log,但大于5色的FCM可部分弥补这一缺陷。一些AML患者的LAIP可见于所有白血病细胞,部分AML的LAIP可仅见于部分白血病细胞。大多数情况下初诊时的LAIP复发时仍可检出,但部分患者LAIP在疾病发展过程中可发生转化,导致假阴性,应用多种抗体组合可减少假阴性的发生。
(2)融合基因:其中以PML-RARα、RUNX1-RUNX1T1和CBFB-MYH11最为常用,敏感性在10-4~10-5。多数有上述融合基因的AML患者在血液学复发前2~3个月已可以观察到分子水平的复发,因此在巩固治疗及随访期间进行规范的MRD监测有助于及时发现有高危复发风险的患者,调整治疗方案以及时干预。
(3)异常表达的泛白血病基因,尤其是WT1基因:约75%的AML患者白血病细胞可检出WT1异常高表达,WT1也是最常用的MRD检测指标之一。由于健康人外周血和骨髓细胞也可以检测到WT1基因的转录,因此WT1更适合作为诱导化疗后早期评价的指标,其作为长期微量MRD动态检测的敏感性不高。有研究显示,标准DA方案(7+3)诱导化疗后,WT1基因表达水平下降<2 log的AML患者复发率显著升高(P=0.004),提示WT1基因可作为诱导化疗后早期评价的指标。
(4)基因突变:在目前的技术条件下,作为MRD监测标志的基因突变应满足以下3个条件,即发生率高、在病程中稳定存在和突变集中于热点部位。目前以NPM1基因A型突变最为常用,NPM1基因突变在AML患者中检出率近30%,80%为A型突变,在疾病进展中也较稳定。因此NPM1突变是理想的MRD监测标志,敏感性可达10-5。英国国立癌症研究所AML工作组对AML-17中346例伴有NPM1突变患者的2 569次标本进行了RQ-PCR分析,多参数分析显示第二次化疗后MRD(NPM1)阳性是唯一的独立预后因素。15%的患者第二次化疗后外周血可检出NPM1突变转录本,随访3年阳性组复发率(82%比30%,P<0.001)及生存率(24%比75%,P<0.001)均劣于阴性组。
三、结语
近年来,随着基因测序技术的快速发展,在AML患者中发现了越来越多的分子异常。这些发现除了增进我们对AML生物学特性的认识、寻找新的靶向治疗手段外,也为AML的分层治疗提供了新的指标。尽管目前分子异常与传统分层体系的结合仍处于不尽完善的状态,但越来越多的数据显示了新综合分层体系的优越性,相信这一领域的发展将对AML的精准治疗产生深远影响。