
靶向BCMA的CAR-T疗法(C-CAR088)治疗RRMM
B细胞成熟抗原(BCMA)是MM的潜在治疗靶点。C-CAR088是一种新型BCMA CAR-T疗法,在复发难治性MM(RRMM)患者的早期临床试验中显示出良好的疗效和可控的安全性。
研究方法
此研究在中国的4个中心展开了剂量递增和扩展研究(NCT04322292、NCT03815383、NCT03751293、NCT04295018),旨在评估C-CAR088在RRMM患者中的安全性和有效性。入组患者既往至少接受了2种方案的治疗,包括蛋白酶体抑制剂(PIs)和免疫调节剂(IMiDs)。C-CAR088经静脉输注给药,输注前预处理方案为3天环磷酰胺/氟达拉滨。
研究结果
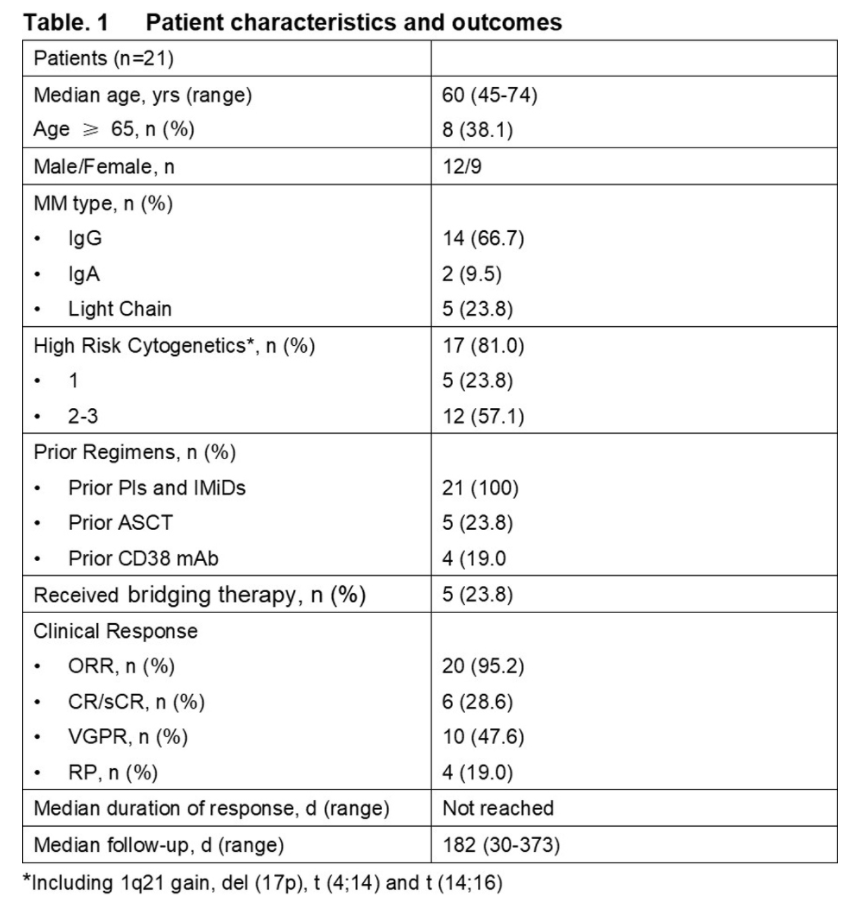
截至2020年7月15日,24例患者接受CAR-T输注,其中21例患者可评估(1.0x106/kg组3例,3x106/kg组11例,4.5~6x106/kg组7例)。中位血细胞单采至CAR-T回输时间为16天。植入成功率为100%。接受CAR-T治疗患者的中位年龄为60岁(范围:45-74岁)。中位既往治疗方案数为4(范围:2-12)。17例(81%)患者至少具有1个高危细胞遗传学改变,而12例(57.1%)患者至少有2个。5例(23.8%)患者接受了桥接治疗(表1)。
C-CAR088治疗的耐受性良好。20例(95%)患者发生1-2级CRS,1例患者发生3级CRS。发生CRS的中位时间为6.5天(范围:1-11天),中位CRS持续时间为5天(范围:2-10天)。4例(19%)CRS患者接受托珠单抗治疗。仅1例患者发生1级神经毒性事件。研究未观察到剂量限制性毒性事件,且所有不良事件均可逆。
中位随访时间为182天(范围:30-375天),最佳总缓解(BOR)包括6例完全缓解(CR)、10例非常好的部分缓解(VGPR)和4例部分缓解(PR)。中位缓解持续时间尚未达到。在3x106/kg剂量组中,45%(5/11)的患者达到CR。外周血中C-CAR088的PK特征表现出剂量依赖性趋势。
结论
研究结果显示,C-CAR088治疗RRMM患者具有良好的安全性和颇具前景的疗效。研究者将继续进行长期随访,以探究C-CAR088在MM患者中的长期疗效。
靶向BCMA的人源化CAR-T疗法CT053治疗RRMM
CT053是靶向BCMA的完全人源化CAR-T疗法。本次披露了CT053治疗RRMM的单臂、开放标签、I期临床研究(NCT03716856,NCT03302403和NCT03380039)的24个月随访结果。
研究方法
这项多中心、探索性I期临床研究纳入了既往接受过≥2线骨髓瘤治疗的RRMM成人患者。在接受氟达拉滨和环磷酰胺预处理治疗2~4天后,21例患者接受了1疗程1.5x108 的CT053治疗。3例患者分别接受了0.5x108、1x108或1.8x108的CT053治疗。研究的主要目标是探索该治疗方案的安全性,次要目标是评估该治疗方案的药代动力学,并根据IMWG 2016标准评估疗效。
研究结果
2017年9月10日至2018年9月22日,共入组24例患者,中位年龄为60.1岁,中位既往治疗线数为4.5,其中41.7%(10/24)进行了自体造血干细胞移植。基线时,10例患者(41.7%)伴有髓外受累,8例患者(33.3%)的美国东部肿瘤协作组(ECOG)评分为2~3分,9例患者(37.5%)的ISS评分为III级。
截至2020年6月30日,9例患者完成了24个月的随访,另外15例患者在完成24个月的随访前停药,其中13例因疾病进展(PD)停药,2例因其他抗癌治疗停药。随访结果显示,总缓解率(ORR)为87.5%(21/24),79.2%(19/24)的 患者获得CR(n=3)或sCR(n=16)。中位缓解持续时间(DOR)为21.8个月,中位无进展生存期(PFS)为18.8个月,6个月和12个月PFS率分别为87%和60.9%。
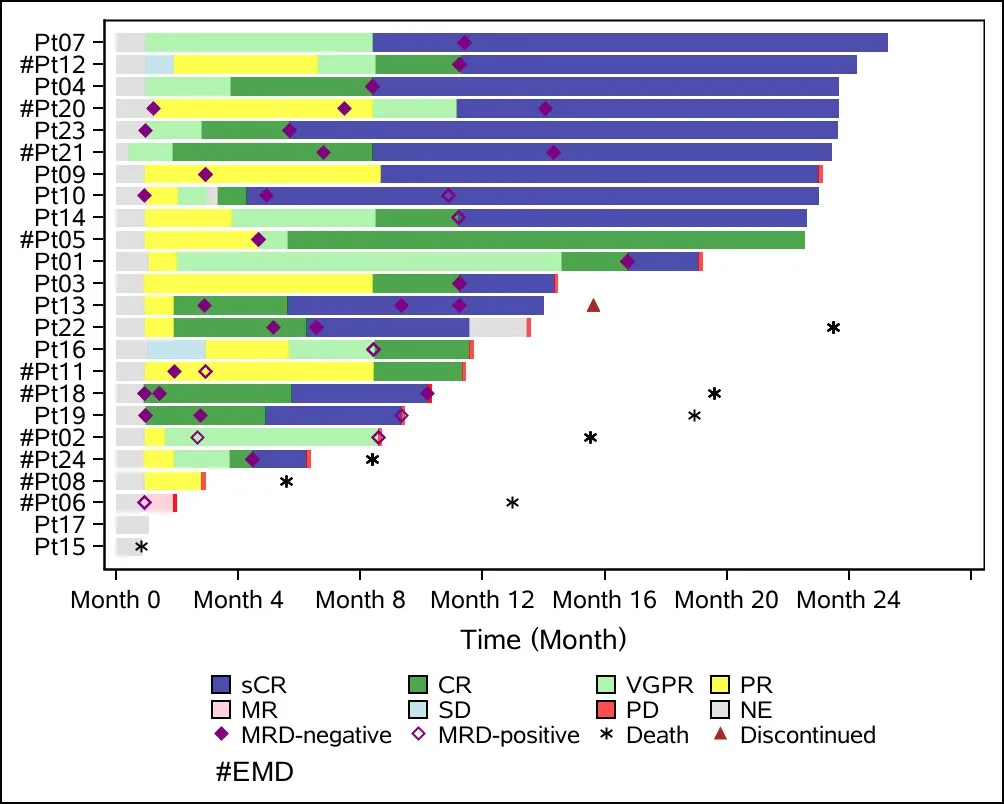
13例PD患者的中位PFS为10.2个月,其中3例患者在治疗6个月内发生PD,6例患者在治疗6~12个月发生PD,4例患者在治疗12~24个月发生PD。与9例持续CR/sCR患者相比,上述PD患者的ECOG评分2~3(46.2% vs 22.2%)、ISS III级(53.9% vs 11.1%)、高危细胞遗传学特征(53.8% vs 33.3%)的患者比例均较高。另外,两组患者伴髓外疾病的发生率相似,分别为46.2%和44.4%。
≥3级治疗相关不良事件(AEs)中最常见的是血液学毒性,包括白细胞减少症(83.3%)、中性粒细胞减少症(85%)、淋巴细胞减少症(79.2%)和血小板减少症(20.8%)。细胞因子释放综合征(CRS)通常在治疗后的1~4天发生,消退的中位时间为6天。24例患者中的15例(62.5%)报告了较低的CRS。所有CRS事件(4例1级、11例2级)均在2~8天内恢复;其中9例患者接受了低剂量(4~6 mg/kg)托珠单抗治疗。1例患者出现了3级神经毒性,表现为癫痫,同时伴有2级CRS,该患者用甲基泼尼松龙、地西泮和丙戊酸钠治疗后,3天内完全恢复。
6例(25%)患者经历了10例治疗相关严重不良事件(SAEs),包括肺部感染(n=3)、肠胃炎(n=1)、中性粒细胞减少性感染(n=1)、发热(n=1)及血液学毒性(n=4)。在数据截止日期之前,1例患者死于SAEs(骨髓衰竭和中性粒细胞减少症)和PD,7例患者死于PD。
BCMA-CAR-T细胞扩增最早可在输液后1~7天检测,并在7~21天达到峰值,基因组DNA的最高浓度达4.5×105 拷贝数/μg,T细胞中位持续时间为172天。BCMA-CAR拷贝最长的持续时间为341天,且未检测到免疫原性。
结论
该研究表明,CT053在RRMM的治疗中具有出色的疗效,患者可获得早期、深层和持久的缓解,中位DOR达21.8个月,且患者对CT053的耐受良好。
BCMA/CD19双靶点新型FasT CAR-T疗法治疗RRMM
为了进一步提高CAR-T治疗RRMM的疗效,延长患者的缓解持续时间,研究者设计了一种双靶点FasT CAR-T疗法,该CAR-T细胞可同时靶向BCMA和CD19(表达于MM细胞及其祖细胞)。本文报道了首个多中心人体临床研究(NCT04236011;NCT04182581)的早期结果,以确定BCMA/CD19双靶点FasT CAR-T(GC012F)在RRMM患者中的安全性、药代动力学(PK)和疗效。
研究方法
BCMA/CD19双靶点CAR由BCMA与CD19 scFv构建而成,由CD8铰链、跨膜结构域、共刺激结构域和CD3z参与。通过血液细胞分离获得外周血(PB)T细胞并制备FasT CAR-T细胞。
2019年9月至2020年4月,研究共招募了16例既往接受多种方案治疗的RRMM患者(年龄范围27-71岁),中位既往治疗线数为5(范围2-7)。根据mSMART标准,93.8%(15/16)的患者具有高危特征,5例患者伴有髓外疾病。16例入组患者中有4例既往接受过抗CD38抗体治疗,93.8%(15/16)的患者既往接受过IMiD治疗,所有患者既往至少接受过1种PI和糖皮质激素治疗,其中3例患者为末次治疗无效的原发难治性MM患者。
CAR-T输注前,患者接受为期3天的氟达拉滨/环磷酰胺预处理方案治疗。单次输注CAR-T细胞的剂量分别为1x105/kg(DL1,n=1)、2x105/kg(DL2,n=9)和3x105/kg(DL3,n=6)。
研究结果
截至2020年7月17日,16例患者均可进行疗效评估,其中15例患者对FasT CAR-T治疗有反应(ORR=93.8%),最早应答出现时间为治疗后第28天。迄今为止,56.3%(9/16)的患者获得了MRD- CR/sCR。在DL3组中,所有患者均达到sCR,其中3例在数据截止时已通过PET-CT证实。在所有可评价疗效的患者中,78.6%(11/14)在第1个月时通过流式细胞术检测达到MRD-。
在数据截止时,入组患者中位随访时间为7.3个月,最长随访时间为输注后10个月。通过qPCR和流式细胞术检测PB中的CAR-T PK。CAR-T中位增殖峰在d10(范围为d8-d14)出现,中位峰拷贝数为140,982(范围为16,011-374,346)拷贝/ug DNA。
GC012F的安全性可接受,87.5%(14/16)的患者出现1-2级CRS,12.5%(2/16)的患者出现3级CRS,CRS的中位持续时间为4天(范围1-8天)。治疗过程中,未发生任何等级的神经毒性事件。1例DL2组患者出现发热,并在COVID-19流行期间于d78死于未知原因。2例患者在第1个月和第3个月时分别达到MRD-的同时发生髓外疾病进展。在第6个月时,DL3组的所有患者(包括强化预处理的患者)均达到并维持MRD- sCR。83.3%(5/6)的DL3患者具有符合mSMART标准的高危特征,且5/6的患者通过10-6 Euroflow进行MRD评估。
结论
BCMA/CD19双靶点FasT CAR-T的初期研究数据显示,早期ORR达93.8%,DL3组100%的患者获得MRD sCR,并且安全性良好。研究数据表明,BCMA/CD19双靶点FasT CAR-T(GC012F)可能成为治疗RRMM患者(包括CD38单抗治疗失败的高危患者)的有效治疗方案。