
美国食品药品监督管理局(FDA)于3月2日批准伊沙妥昔单抗(isatuximab)与泊马度胺和地塞米松联合(Isa-Pd方案)用于治疗既往接受过≥2种疗法(包括来那度胺和蛋白酶体抑制剂)的多发性骨髓瘤成年患者。
伊沙妥昔单抗是一种抗CD38单克隆抗体,通过静脉输注(IV)给药,可帮助免疫系统攻击骨髓瘤细胞。
FDA肿瘤学卓越中心(OCE)主任Richard Pazdur博士表示:“虽然现在还无法治愈多发性骨髓瘤,但伊沙妥昔单抗是另一种靶向CD38的治疗选择,已被FDA批准用于既往治疗后疾病进展的多发性骨髓瘤患者。在临床试验中,这种疗法使疾病进展或死亡的风险降低了40%。”
ICARIA-MM研究概况
ICARIA-MM(NCT02990338)是一项多国多中心、开放标签、两臂、随机3期研究,共纳入了307例复发/难治性多发性骨髓瘤患者(至少接受了包括来那度胺和蛋白酶体抑制剂在内的2种治疗)。患者被随机分配(1:1)接受伊沙妥昔单抗联合泊马度胺和小剂量地塞米松(Isa-Pd,154例患者)或泊马度胺和小剂量地塞米松(Pd,153例患者)治疗。
医脉通血液科既往也发布过此研究相关的报道(点击下列标题即可阅读相关报道)。
2019ASCO 第一时间 | 聚焦多发性骨髓瘤最新研究进展
2019 EHA 会议速递 | RRMM新选择:抗CD38单克隆抗体Isatuximab联合标准治疗
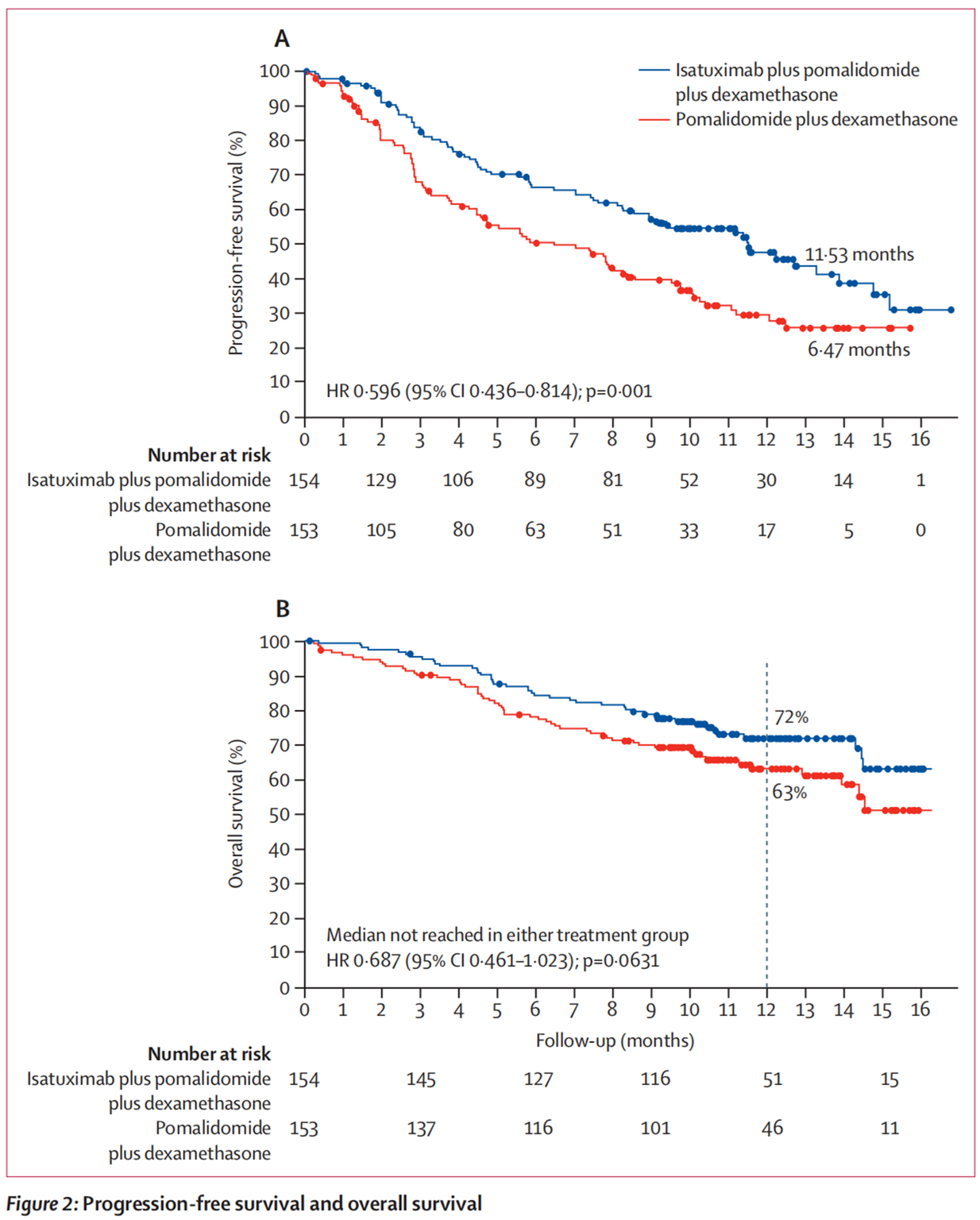
主要疗效指标是由独立委员会使用国际骨髓瘤工作组(IMWG)标准,根据M蛋白的中央实验室数据和放射影像学检查结果评估的无进展生存期(PFS)。中位随访时间为11.6个月,Isa-Pd治疗组的总缓解率为60.4%,而Pd治疗组为35.3%。Isa-Pd治疗组的中位PFS为11.53个月(95%CI: 8.94-13.9),而Pd治疗组为6.47个月(95%CI: 4.47-8.28)。PFS的改善意味着接受Isa-Pd治疗的患者疾病进展或死亡的风险降低了40%(HR=0.596; 95%CI: 0.44-0.81; p=0.0010)。
最常见的不良反应(≥20%的患者)是中性粒细胞减少、输注相关反应、肺炎、上呼吸道感染和腹泻。Isa-Pd组中有1名患者(<1%)因治疗相关不良事件(败血症)而死亡,而Pd组中有2名患者(1%)因治疗相关不良事件(肺炎和尿路感染)死亡。
临床应用相关建议
伊沙妥昔单抗的推荐剂量为每周10mg/kg,连续4周静脉输注,每2周与泊马度胺和地塞米松联合使用,直至疾病进展或出现不可接受的毒性[3]。
该药物可能引起严重的副作用,包括静脉输注相关反应。如果发生≥3级的静脉输注相关反应,则应永久停用该药物,并由医护人员制定适当的医疗措施。FDA指出,在接受该药物治疗的多发性骨髓瘤患者的对照研究中,观察到第二原发恶性肿瘤的发生率更高。[2]
FDA还强调实验室检测干扰可能是由伊沙妥昔单抗引起的,例如伊沙妥昔单抗可能会干扰需要输血患者的抗体筛查,患者接受该药物治疗时应告知血库。伊沙妥昔单抗也可能干扰M蛋白的检测,从而影响完全缓解的确定。