
造血干细胞移植或嵌合抗原受体T细胞(CAR-T)治疗后复发/难治性(R/R)弥散性大B细胞淋巴瘤(DLBCL)患者,或不适合此类治疗的患者,需要更多治疗选择。Loncastuximab tesirine(ADCT-402;Lonca)是一种抗体-药物偶联物(ADC),包含一种靶向人CD19的人源化抗体,该人源化抗体偶联于吡咯苯二氮卓类二聚物毒素上。它的靶标,人CD19抗原,是经典的B细胞标志物,在大多数恶性B细胞上均以正常至高水平表达。
在R/R B细胞非霍奇金淋巴瘤患者中进行的Lonca的1期剂量递增和剂量扩展试验的初步数据显示,Lonca在DLBCL中具有显著的临床活性和可接受的安全性,确定2期推荐剂量为150μg/kg。本文介绍了2期试验中接受Lonca治疗的前52例R/R DLBCL患者的中期无效性分析结果。
研究方法
这项独立、多中心、开放标签、两阶段的2期临床试验(NCT03589469)目前正在入组≥18岁的R/R DLBCL患者,这些患者既往接受了≥2种多药系统治疗方案治疗且无大肿块(肿瘤≥10cm)。主要目标是通过总缓解率(ORR)评估单药Lonca的疗效。次要目标是进一步评估疗效(包括缓解持续时间[DOR]、无进展生存期[PFS]和总生存期[OS]),表征Lonca的安全性、药代动力学和免疫原性,并评估Lonca对健康相关生活质量的影响。
患者每3周(1个周期)接受一次Lonca30分钟静脉输注,前2个周期的剂量为150μg/kg,随后为75μg/kg,治疗最多持续1年或直到疾病进展或不可接受的毒性或其他停药标准,以先出现者为准。当第52例患者进行了2次肿瘤评估(开始研究药物后约12周)时,进行预先计划的中期无效性分析,如果前52名患者中有10名以上对Lonca有反应,则该研究计划进行全部入组。ORR(完全缓解[CR] +部分缓解[PR])由一名独立审核者确定。
研究结果
中期分析包括52例DLBCL患者。患者的中位年龄为62.5岁(范围为24-84),既往治疗中位数为3种(范围2-7;表1)。截至2019年5月1日,患者接受的Lonca的中位周期数为2.5(范围为1-9)。
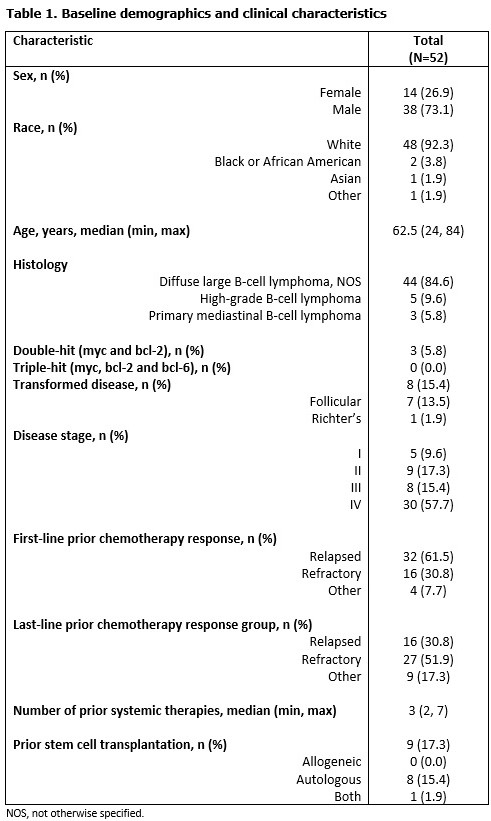
无效性分析人群(52例)的ORR为44.2%,符合无效性要求。10/52例(19.2%)和13/52例(25.0%)患者分别达到CR和PR。此外,有11例患者(21.2%)病情稳定(图1)。
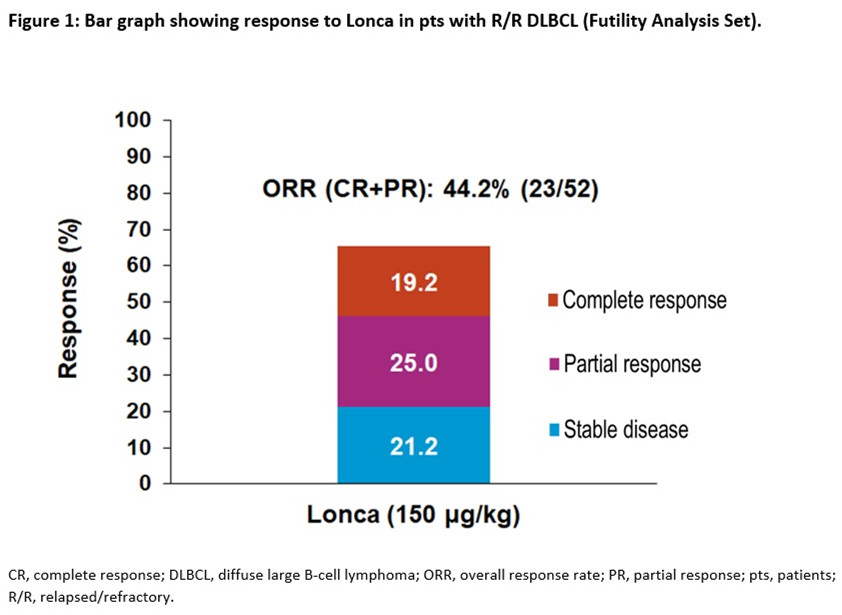
所有(100%)患者至少有1例治疗中出现的不良事件(TEAE),其中37例(71.2%)患者为≥3级TEAE。无论与研究治疗的关系如何,最常见的所有等级非血液学TEAE是γ-谷氨酰转移酶(GGT)增加(24[46.2%])、发热(18[34.6%])和低血钾(15[28.8%]);分别有5/52例(9.6%)患者和6/52例(11.5%)患者报告了胸腔积液和周围水肿;这些患者中有1例≥3级(胸腔积液)。最常见的≥3级TEAE是GGT增加(11[21.2%]),高钙血症(4[7.7%])和低钾血症(3 [5.8%])。尚无≥3级皮肤相关TEAE的报道。
最常见的所有等级血液学异常是血小板计数降低*(34 [65.4%])、中性粒细胞计数降低*(27[51.9%])和贫血(14[26.9%]),最常见的≥3级血液学异常是中性粒细胞计数降低*(15[28.8%])、血小板计数降低*(10[19.2%])和贫血(6[11.5%])。总体而言,26例(50%)患者因TEAE导致剂量减少或延迟,10例(19.2%)患者因TEAE导致治疗中断。
*实验室异常数据需报告:血小板计数降低,中性粒细胞计数降低,以免漏报这些事件。
结论
Lonca在R/R DLBCL患者中显示出令人鼓舞的单药抗肿瘤活性和可控的毒性。符合无效性要求,现在正在2期试验患者入组中。