
请仔细阅读说明书并在医生的指导下使用
通用名称: 注射用盐酸米托蒽醌
英文名称: Mitoxantrone Hydrochloride For Injection
商品名称: 奥麦
【成份】
本品活性成份为盐酸米托蒽醌,
化学名称:1,4-二羟基-5,8-双[[2-[(2-羟乙基)氨基]乙基]氨基]-9,10-蒽醌二盐酸盐
化学结构式:
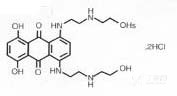
分子式:C22H28N4O6·2HCl
分子量:517.41
辅 料:甘露醇
【适应症】
【用法用量】
将本品溶于 50 ml 以上的生理盐水或 5%葡萄糖注射液中静脉滴注,时间不少于 30 分钟。
成人: 单用本品一次 12~14 mg/m2体表面积,每 3~4 周一次;或 4~8 mg/m2,一日一次,连用 3~5 天,间隔 2~3 周。
联合用药: 按体表面积一次 5~10 mg/m2。
【禁忌】
1.对本品过敏者禁用。
2.妊娠及哺乳期妇女禁用。
3.有骨髓抑制或肝功能不全者禁用。
4.呈恶液体质,伴有心、肺功能不全的病人禁用。
【注意事项】
1.用药期间应密切随访血象、肝肾功能、心电图, 必要时还需测定左心室排血量、超声心动图等, 当白细胞<1500/mm3应停药。
2.有心脏疾病、用过蒽环类药物或胸部放射治疗的患者, 应密切注意心脏毒性的发生。用药过程中,注意有无咳嗽、气急、浮肿等提示心力衰竭的症状。
3.与其它抗肿瘤药物联用时,可能会加重对骨髓的抑制,应减量。
4.不宜作鞘内注射,可能会引起截瘫。
5.本品不能与其它药物共同滴注。静滴时,注意局部药液有无渗漏,如有发生,停止滴注,选另一静脉滴入。
6.本品遇低温可能析出晶体,可将输液瓶置热水中加温,晶体溶解后使用。
7.本品由尿排出,可使尿呈蓝色,不需处理。
【FDA妊娠药物分级】
D
【孕妇及哺乳期妇女用药】
米托蒽醌有潜在性的生殖毒性,故孕妇禁用。本品可从乳汁分泌致乳儿损伤,选用时应权衡利弊,哺乳妇女最好不用。
【毒理研究】
动物试验提示/本品具有致突性和致癌作用。尚无充分的和`严格对照的孕妇临床研究资料,若患者在孕期使用本品或使用本品时怀孕,应被告知对胎儿的潜在危害。有生育可能的女性患者应^避免怀孕。
本品可在人乳中排泄,有报道本品末次给药后 28 天乳汁中仍可明显检出(18 ng/ml)。鉴于本品可引起婴儿严重的不良反应,给药前应停止哺乳。
【药理作用】
米托蒽醌为蒽/醌类抗肿瘤药,通过与 DNA 反应而产生抗肿瘤作`用,但其作用机理尚未完全阐明。本品对体外培养的增殖性和非增殖性人细胞均有杀细胞作用,这提示其缺乏细胞周期特异性。
【药代动力学】
本品静脉滴注/后,迅速分配到各组织中与其结合,以后缓慢`释放,以肝脏、骨髓、心肺等为多,分布容积为 522L/m2,血药浓度很快下降。在多数病例中,药时曲线符合三室模型。
静脉给药 15~90 mg/m2,给药剂量与血药浓度^呈线性关系。
本品在血浆中的浓度为 26-455 ng/ml 时,血浆蛋白结合率为 78%。本品主要经肝脏代谢,通过胆汁从粪排出,6~11% 经肾脏排泄。排出物主要为原药,亦有少量的代谢物。本品 T1/2为 40~120 小时,有腹水等增加药物分布容积因素者,T1/2 可进一步延长。此时药物应减量。
本品在老年人群的清除率比年轻人降低(前者 21.3L/hr/m2,后者 28.3L/hr/m2)。肝功能不全者,排除减少,其 AUC 值是肝功能正常者的 3 倍。通过血透和腹透不能使本品完全排除。
【化学成份】
化学名称为:1,4-二羟基-5,8-双〔〔2-〔(2-羟乙基)氨基〕乙基〕氨基〕-9,10-蒽醌
分子式:C22H28N4O6
分子量:444.5
【是否OTC】
否
【核准日期】
2010-10-01
【修改日期】
2010-10-01