
超高危多发性骨髓瘤(Ultra High-Risk Multiple Myeloma,UHRMM)是指在24个月内导致患者死亡的骨髓瘤,它被认为是一种以同时出现多种高危细胞遗传学标志物为特征的疾病。表现为:国际分期系统ISS分期为3期、浆细胞高度增殖、存在特定的基因改变,包括del(17p)和可能存在的其他基因组异常[1-2]。
危险因素
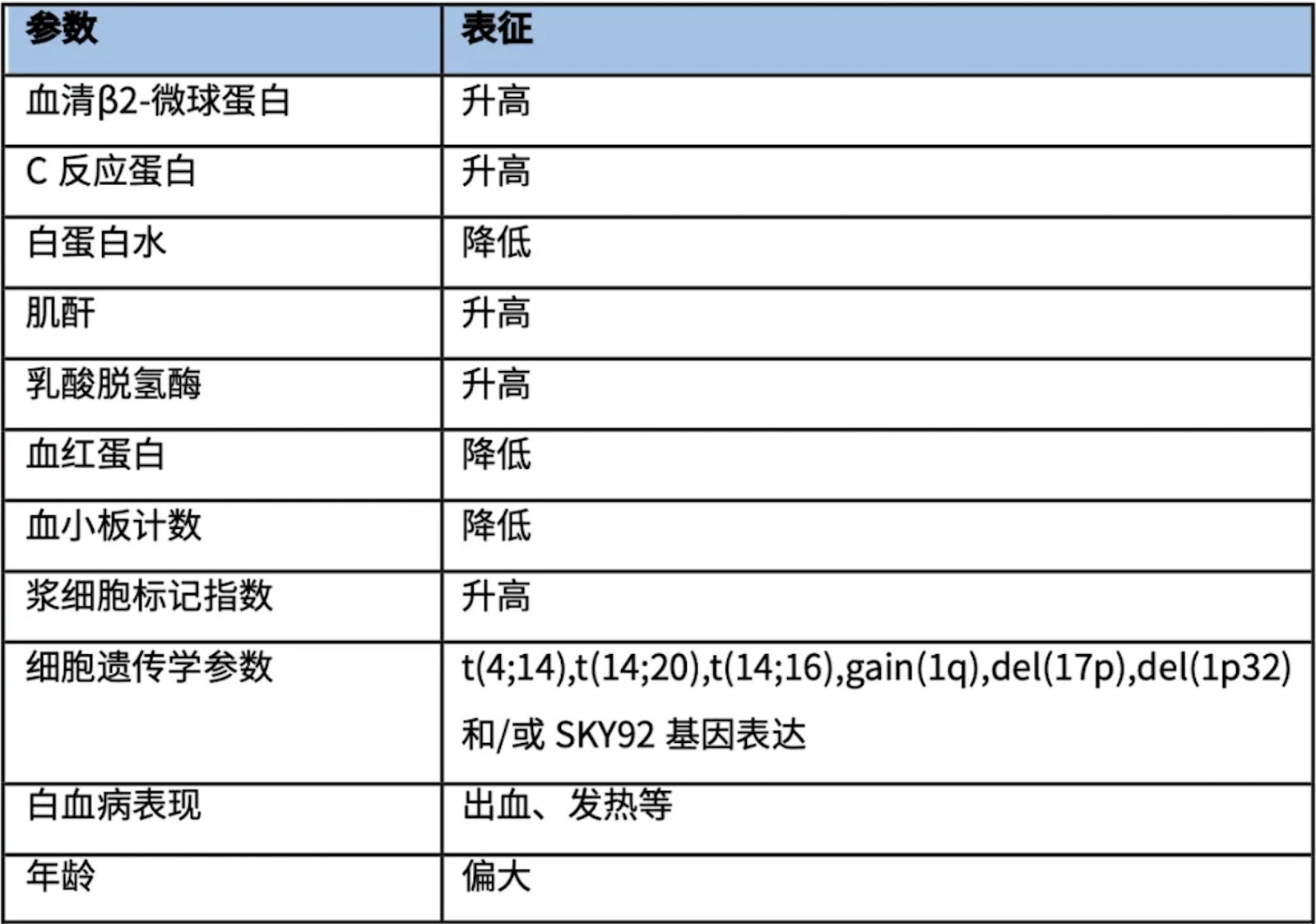
UHRMM是一种严重的疾病,占病例的15%至20%,尽管治疗手段不断进步,但患者仍会在24个月内死亡。相关危险因素有:血清β2-微球蛋白水平高;C反应蛋白水平高;白蛋白水平低;肌酐水平高;乳酸脱氢酶水平高;血红蛋白水平低;血小板计数低;浆细胞标记指数高;白血病表现;细胞遗传学参数不佳[如t(4;14)、del(17p)或t(14;16)]及1q增益/扩增等;以及肿瘤学中常见的年龄偏大。此外,核型异常(间接反映浆细胞增殖)也是一个强有力的预后参数[3]。
表1. UHRMM危险因素
诊断
诊断UHRMM的标准包括评估特定因素,如骨髓克隆性浆细胞的百分比、是否出现CRAB症状(高钙血症、肾功能衰竭、贫血或溶解性骨病变)、骨髓克隆性浆细胞百分比、血清游离轻链比值以及影像学上的局灶性病变。此外,t(4;14)、t(14;16)、t(14;20)、del(17p)和gain(1q)等基因异常在识别超高危患者方面也起着至关重要的作用。许多预后因素都有助于确定这些患者,包括年龄、肾功能不全、合并症、ISS 3期、高增殖、白血病表现以及通过间期荧光原位杂交或基因组学确定的获得性基因改变。这些预后参数的多种组合可界定超高危患者[2-3]。
用于诊断UHRMM的肿瘤生物标志物包括单核细胞趋化蛋白-3(MCP-3)、巨噬细胞炎症蛋白-1α(MIP-1α)、血管内皮生长因子(VEGF)、成纤维细胞生长因子-2(FGF-2)、分叉蛋白和转化生长因子-α(TGF-α)。这些生物标志物在预测MM的进展方面起着至关重要的作用,对于识别疾病进展风险超高的患者至关重要。这些标志物水平较低与MM风险有关,在未来的MM患者中观察到这些标志物水平下降,而在对照组中则保持稳定。值得注意的是,TGF-α的低水平与MM进展风险的增加有独立联系,这突显了其作为疾病早期检测标志物的潜力[4]。
治疗策略
抑制骨髓瘤细胞对骨髓基质细胞的粘附、抑制血管生成、改善免疫环境是有效治疗MM患者的关键。因此,蛋白酶体抑制剂(PIs)、免疫调节剂(IMiDs)、抗CD38单克隆抗体和自体造血干细胞移植(ASCT)的整体治疗方法同样在UHRMM患者的治疗中占有至关重要的地位。使用PIs、IMiDs和抗CD38单抗进行诱导治疗是治疗UHRMM的首选方案。当使用PIs、IMiDs和抗CD38单克隆抗体作为诱导疗法而无法获得深度治疗反应时,可能需要使用具有新型作用模式的药物来治疗患者。例如,BCMA靶向治疗,如嵌合抗原受体-T细胞疗法(CAR-T)和抗体药物偶联物(ADC),在这种情况下可能是有效的选择。可在早期阶段和自体移植物中实现最小残留病(MRD)阴性。
持续的MRD阴性是MM患者长期生存的关键,但对于UHRMM患者,即使MRD阴性,也需要新的治疗策略。实现持久的MRD阴性是改善UHRMM临床疗效的关键。所以,对于UHRMM,可能有必要改变治疗策略,通过新的作用机制消灭最小残留骨髓瘤细胞。例如,对MRD阳性的患者及早使用BCMA靶向药物,可预防疾病的侵袭性复发,如果MRD阴性,则适合进行外周血干细胞采集,然后再进行ASCT。然而,如果在使用具有新作用机制的药物治疗后MRD阳性仍然存在,那么直接进行外周血干细胞采集后进行ASCT,还是采用包括细胞毒性药物[如VTD-PACE(硼替佐米、沙利度胺、地塞米松、顺铂、多柔比星、环磷酰胺和依托泊苷)]在内的另一种强化再诱导疗法,是否会带来更好的疗效,目前仍不清楚。但是考虑ASCT可延长MRD阳性患者的PFS,即使强化诱导治疗后MRD状态为阳性,也应进行ASCT。鉴于移植后治疗尚未被证明能有效完全消除MRD,因此,具有新作用模式的药物或移植后治疗中的类似疗法是否更有益仍存在争议。但是肯定的是长期维持治疗可能有利于从MRD阳性转为阴性,并且,来那度胺维持治疗直至疾病进展是移植后治疗的标准疗法。
总的来说,使用PIs、IMiDs和抗CD38单克隆抗体进行诱导治疗是治疗UHRMM的首选方案。如果包括诱导治疗在内的三个疗程未能达到VGPR,替代疗法[如BCMA靶向疗法或传统化疗(VTD-PACE)]可能改善治疗反应,包括根除MRD。如果自体移植物的MRD状态为阳性,那么移植后的强化治疗是UHRMM患者实现持久MRD阴性或防止复发的关键。如果达到MRD阴性,最好选择含3类药物的联合巩固治疗,然后进行PPIs、I加IMiDs或抗CD38单抗联合来那度胺维持治疗。如果MRD呈阳性,具有新作用模式的替代疗法可能会消灭残留的骨髓瘤细胞。比如针对BCMA、G蛋白偶联受体家族C组5成员D(GPRC5D)和Fc受体同源物5(FcRH5)靶点的治疗方式。最小残留骨髓瘤细胞表现出逃避免疫活性的机制,因此,免疫检查点抑制剂被认为是有效的治疗方法,抗PD-1单克隆抗体可有效攻击最小残留骨髓瘤细胞;SLAMF7在大多数骨髓瘤细胞中过度表达,埃罗妥珠单抗(一种抗SLAMF7抗体)和免疫调节药物联合疗法可有效提高免疫活性并抑制可溶性SLAMF-7,1q21基因扩增的患者[5-6]。
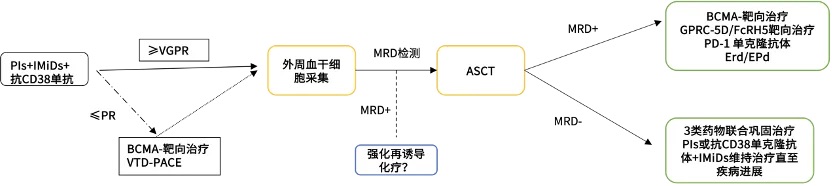
图1. UHRMM治疗流程图
*MRD,最小残留病;PIs,蛋白酶体抑制剂;IMiDs,免疫调节药物;BCMA,B细胞成熟抗原;VTD-PACE,硼替佐米、沙利度胺、地塞米松、顺铂、多柔比星、环磷酰胺加依托泊苷;ASCT,自体造血干细胞移植;GPRC5D,G-蛋白偶联受体家族C组5成员D;FcRH5,Fc受体同源物5;PD-1,程序性死亡受体-1;ERd,艾洛珠单抗、来那度胺加地塞米松;EPd,埃罗妥珠单抗、泊马度胺加地塞米松;PR,部分应答;VGPR,非常好的部分应答
总结
UHRMM与标准风险MM相比,这种亚型具有某些高风险特征,其病程更具侵袭性,预后更差。患者通常需要更密集的治疗策略,包括ASCT、化疗、靶向治疗、免疫治疗的组合,更多的应该考虑使用临床试验和个性化治疗方案,以此可能提高疗效并有效控制病情。